Biopolymères, biologie structurale (BIBS)
Caractérisation physicochimique des bioressources, naturelles ou transformées, sur une gamme d’échelles allant du millimètre au nanomètre.
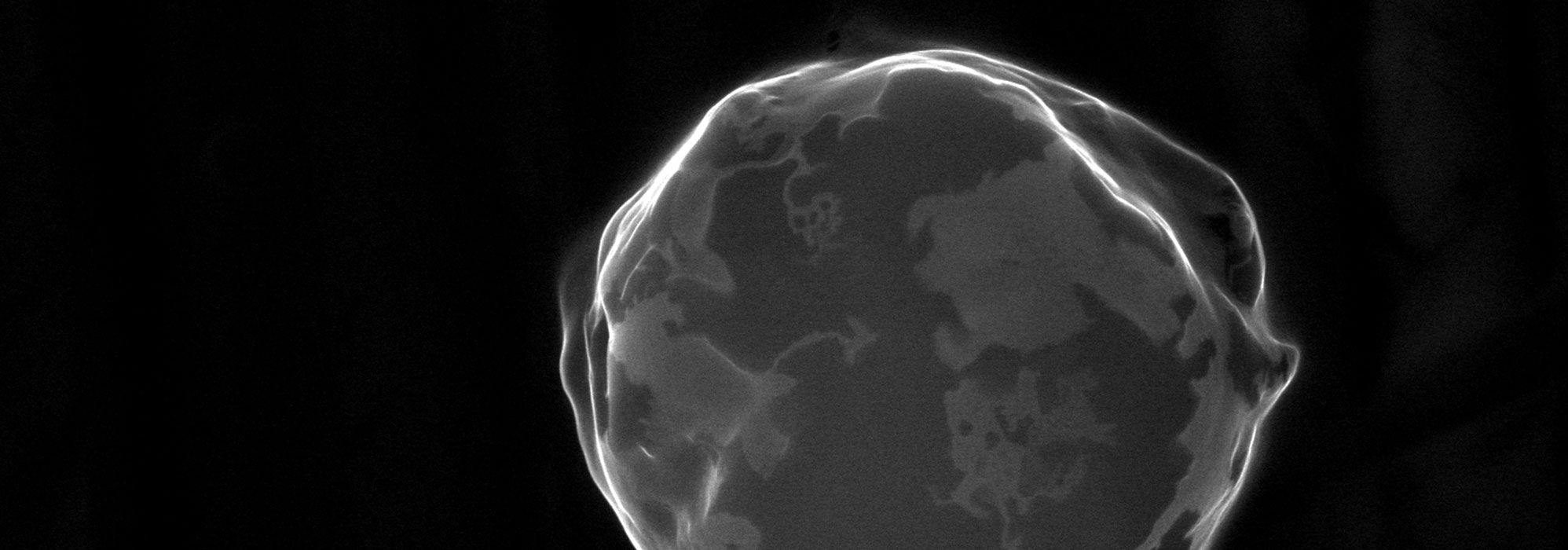
Biopolymères, biologie structurale (BIBS)
Caractérisation physicochimique des bioressources, naturelles ou transformées, sur une gamme d’échelles allant du millimètre au nanomètre.
Biopolymères, biologie structurale (BIBS)
BIBS développe et propose des méthodes de caractérisation multi-échelles des biopolymères (polysaccharides, polymères lipidiques, protéines) par différentes modalités analytiques. Combinées, ces modalités permettent d’accéder à la composition et à la structure des biopolymères, à leur organisation (assemblages, interactions), localisation et dynamique.
Les systèmes d’étude sont des systèmes biologiques d’origine biosourcée, naturels (plantes terrestres ou marines, organes de plantes, cellules...) ou transformés (aliments, matrices alimentaires, biomatériaux...). Les analyses de la plateforme aident à décrire ces systèmes sur des échelles allant du nanomètre au millimètre, à mieux comprendre les relations pouvant être établies entre leurs structures et leurs propriétés ou fonctionnalités, ainsi qu’à mieux maîtriser leurs étapes de construction ou de déconstruction.
Les domaines d’application privilégiés de la plateforme BIBS sont les sciences végétales et marines, les sciences de l’aliment, la chimie verte, les biomatériaux, la formulation pour les secteurs de la cosmétique et de la santé.
Expertises et services
- Identification et quantification de biopolymères (polysaccharides, protéines, polymères lipidiques) dans des systèmes complexes d’origine biosourcée,
- Caractérisation de la structure fine de biopolymères (séquence, modifications, connectivité entre unités constitutives…),
- Phénotypage chimique (criblage de la variabilité compositionnelle et structurale dans une série d’échantillons),
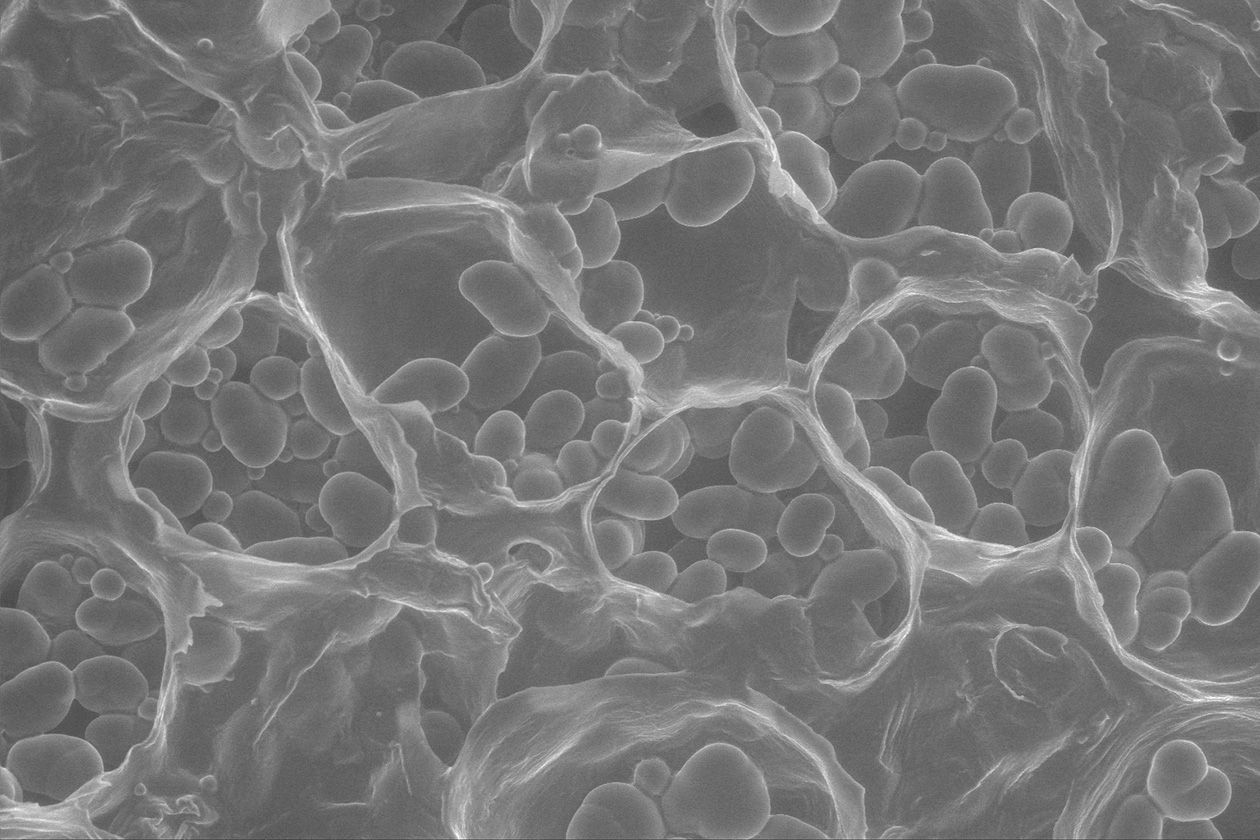
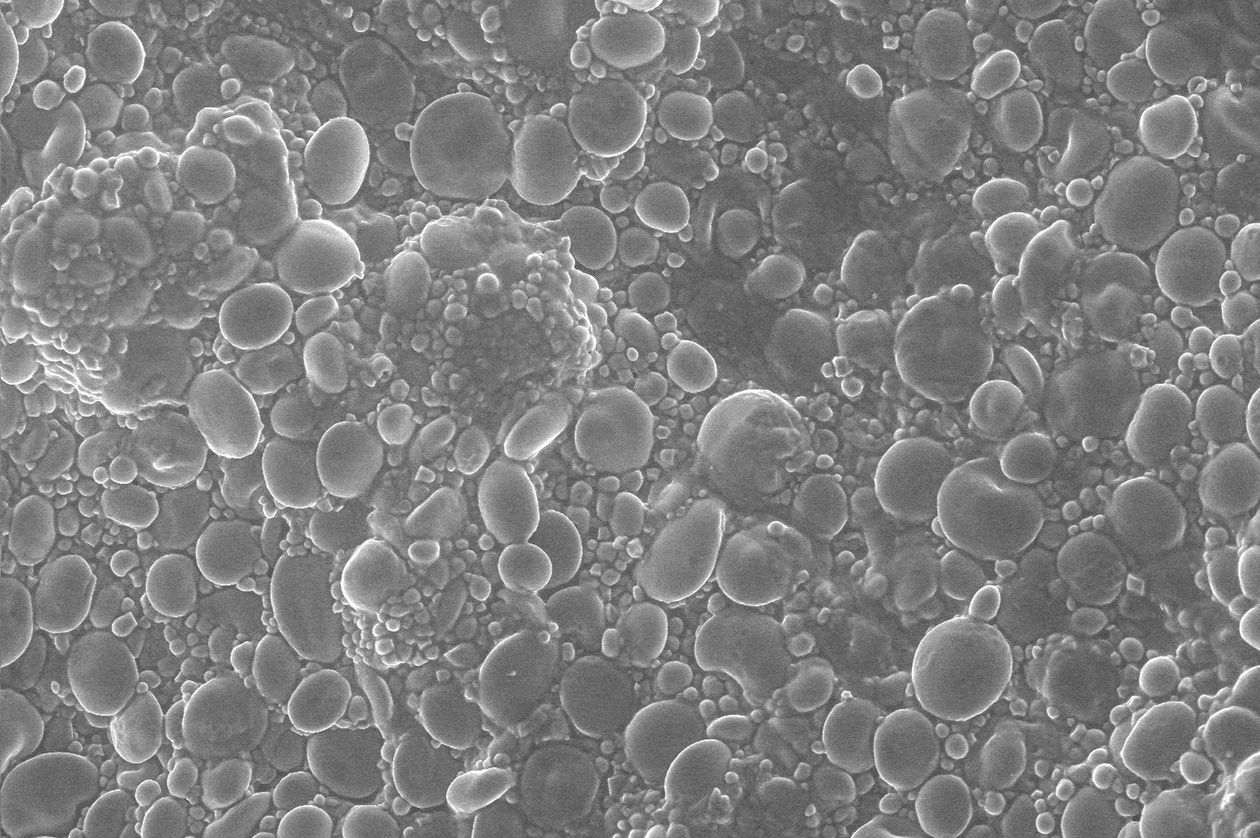
- Observation de systèmes et distribution de biopolymères à différentes échelles et par différentes modalités d’imagerie (microscopie, imagerie par spectrométrie de masse, µIRM, analyse d’images),
- Mesure de dynamiques moléculaires et interactions (phénomènes de diffusion, porosité),
- Analyse d’images et développement de logiciels bioinformatiques pour l’interprétation et l’annotation de spectres (spectrométrie de masse, microscopie, RMN...).
Moyens et équipements
Spectrométrie de masse :
- Spectromètre à ionisation ESI ou MALDI,
- Analyseurs à haute résolution (MS et MS/MS, mode CID et CTD),
- Matériels de mobilité ionique et d’imagerie par spectrométrie de masse.
Microscopie :
- Microscopes photoniques (confocal et fluorescence),
- Microscopes électroniques à balayage et transmission,
- Microscopes à force atomique (AFM couplé en Raman),
- Matériels de préparation pour la microscopie.
Résonnance magnétique nucléaire (RMN) :
- Spectromètres haut champ (liquide et solide),
- Spectromètres bas champ (relaxométrie RMN),
- Accessoires de micro-imagerie par RMN.
Chemotypage :
- Automates d’extraction et de préparation d’échantillons compatibles avec de grandes séries,
- Chromatographes en phase gazeuse (détection FID ou spectrométrie de masse),
- Chromatographe en phase liquide (HPAEC-PAD, UPLC-Fluo).
Bioinformatique :
- Logiciels pour l’interprétation et l’annotation de spectres,
- Algorithmes d’analyse d’images (fusion, recalage, modélisation).







Comment soumettre un projet ?
La plateforme BIBS est ouverte à la communauté scientifique, académique et privée. Elle apporte son appui à l'analyse et au traitement de données sous la forme de prestations de service ou de collaborations. S’ils s’avèrent nécessaires au projet, des développements de méthodes peuvent être envisagés en collaboration. L’habilitation d’utilisateurs est également possible sur certains équipements.
Adressez votre demande à la plateforme par mail à l’adresse contacts-bibs@inrae.fr. Décrivez brièvement votre projet et la problématique posée. L’adéquation de la demande à l’expertise technique et scientifique de la plateforme est étudiée par les différents responsables des composantes analytiques de BIBS. Une réponse vous est envoyée dans un délai d’une à deux semaines. Si le projet peut être pris en charge par la plateforme, la réponse s’accompagne d’une proposition de stratégie analytique, d’un devis et d’une planification.
Exemple d'utilisation
Qualification de nouvelles enzymes fongiques actives sur des polysaccharides (LPMO) par la caractérisation fine de leurs produits de réaction
Les monooxygénases polysaccharidiques lytiques (LPMO) représentent une nouvelle classe d’enzymes prometteuses pour prétraiter la biomasse végétale et améliorer les rendements de conversion de la lignocellulose dans la filière des biocarburants et en chimie verte. Le laboratoire Biodiversité et biotechnologie fongiques (BBF), porteur du projet soumis à la plateforme BIBS, mène des recherches sur les stratégies enzymatiques développées par les champignons filamenteux. Il a identifié plusieurs candidats à activité LPMO.
Dans ce contexte, BIBS a effectué différents types d’analyses, par spectrométrie de masse, RMN du solide et chemotypage. Les résultats ont aidé le BBF à qualifier les activités LPMO criblées dans la biodiversité fongique. Ils ont affiné les connaissances sur le mode d'action de ces enzymes, en déterminant la structure fine des produits libérés dans le milieu réactionnel à partir de différentes sources de LPMO et sur différents types de substrats, cellulosiques ou non. Enfin, les résultats ont fourni des informations structurales et dynamiques sur les changements qui se produisent avant et après l'action des LPMO sur la cellulose, en particulier sur la modification de la cristallinité et l'identification des sites d'interaction.
Pour en savoir plus : Filiatrault-Chastel C. et al. (2019). AA16, a new lytic polysaccharide monooxygenase family identified in fungal secretomes. Biotechnology for Biofuels, 12:55.
Contact
BIBS
INRAE, UR1268
La Géraudière
44300 Nantes
Région : Pays de la Loire +33 (0)2 40 67 50 34
+33 (0)2 40 67 50 34
contacts-bibs@inrae.fr
Site de la plateforme
THÉMATIQUES : Biologie structurale, biophysique, biochimie
TUTELLES : INRAE
INFRASTRUCTURES NATIONALES : EMPHASIS France
LABELLISATION IBiSA : 2010
RESPONSABLES SCIENTIFIQUES :
Sophie Le Gall
RESPONSABLES TECHNIQUES :
David Ropartz, Bruno Novales, Loic Foucat, Sophie Le Gall, Dominique Tessier
RESPONSABLES QUALITÉ :
Stéphane Bansard
MOTS CLÉS : Biopolymères, Assemblages, Composition, Structure, Localisation, Multi-échelles, Spectrométrie de masse, RMN, Imagerie, Microscopie, AFM, Chemotypage, Analyse d’images, Traitement de données, Système biosourcé, Plantes, Aliments, Matrice alimentaire, Biomatériau, Algue, Paroi
Fiche mise à jour en 2021










