Imagerie des sciences du vivant (ISDV) - In vitro
Imagerie in vitro pour la recherche biologique et la recherche médicale : instrumentation, acquisition et analyse d’images.
Imagerie des sciences du vivant (ISDV) - In vitro
Imagerie in vitro pour la recherche biologique et la recherche médicale : instrumentation, acquisition et analyse d’images.
Imagerie des sciences du vivant (ISDV) - In vitro
La plateforme ISDV-In vitro offre un large éventail d'outils microscopique pour l'imagerie cellulaire et tissulaire, ainsi qu’un savoir-faire en traitement et analyse d’images. Ces moyens d'imagerie sont distribués sur plusieurs sites : microscopie photonique et cytométrie à l’Institute of advanced biosciences (IAB), microscopie électronique de la cellule et imagerie cellulaire au Grenoble institute of neurosciences (GIN), imagerie cellulaire et tissulaire au laboratoire TIMC-IMAG et microscopie pour la biophysique au Laboratoire interdisciplinaire de physique (LIPhy). Chaque site représente un type de compétences et de savoir-faire propres pouvant être apportés en plus-value par rapport à une simple ouverture d'accès aux ressources technologiques de la plateforme.
Expertises et services
- Microscopie à épifluorescence et lumière transmise multiparamétrique : Z séries, multi-longueur d’ondes, multi-champs, mosaïque d’images,
- Vidéomicroscopie : imagerie calcique, migration cellulaire, différenciation neuronale, trafic vésiculaire, FRAP, photoactivation,
- Microscopie de fluorescence à onde évanescente TIRF et détection de molécules uniques par SmTIRF,
- Microscopie confocale 3D, microscopie spectrale, FRAP, FLIP, FRET, photoactivation et haute résolution par module Airyscan,
- Microscopie confocale spinning disk FRAP, TIRF, HiLo et imagerie de super résolution PALM et STORM,
- Microscopie biphotonique : imagerie calcique in vivo, photoactivation, imagerie 3D intravitale, génération de seconde harmonique (SHG),
- Optogénétique et photomanipulation (CALI, PA),
- Imagerie de durée de vie de fluorescence (TCSPC-FLIM),
- Optique adaptative pour la microscopie quantitative,
- Cytométrie en flux : analyse multiparamétrique et tri cellulaire, traitement automatisé et analyse des données,
- Analyse d’images : développement de logiciels et d’algorithmes pour le traitement et la quantification d’images.
Moyens et équipements
Microscopie photonique et cytométrie (IAB) :
- 4 stations confocales inversées avec incubateurs cellulaires Zeiss, TILL-FEI,
- 2 modules de spectroscopie à corrélation de fluorescence (FCS) Confocor Zeiss,
- 2 systèmes biphotoniques équipés de modules FLIM Becker & Hickl,
- 4 vidéomicroscopes à champ large, motorisés et de super résolution (STORM) Zeiss,
- 2 modules d’excitation par onde évanescente (TIRF) Zeiss Errol, TILL-FEI,
- 5 microscopes droits à épifluorescence et autres contrastes dont un avec illumination structurée Apotome Zeiss,
- Cytomètres en flux analyseurs BD LSRII et Accuri,
- Trieur de cellules BD FACS Aria,
- 5 stations avec logiciels d’analyse et traitement des données off line,
- Spectromètres d’absorption et de fluorescence, équipements de métrologie.
Microscopie électronique de la cellule (GIN) :
- Microscope électronique à transmission Jeol 1200 EX avec caméra Veleta,
- 2 ultra(cryo)microtomes Leica Ultracut,
- Appareil de congélation à haute pression Leica HPM100,
- Appareil de cryosubstitution Leica AFS2,
- Evaporateur Jeol.
Imagerie cellulaire (GIN) :
- 2 microscopes à épifluorescence Nikon,
- 2 vidéomicroscopes plein champ Zeiss Roper,
- Vidéomicroscope plein champ et FRAP Leica Roper,
- Microscope plein champ et TIRF Nikon Roper,
- Microscope spinning disk TIRF, FRAP, PALM et STORM Zeiss Roper,
- Microscopes confocaux Leica TCS SPE et Zeiss LSM710 avec module Airyscan,
- Microscopes biphotoniques LaVision BioTec et Zeiss 7MP.
Imagerie cellulaire et tissulaire (TIMC-IMAG) :
- Microscope confocal LSM710,
- Station de vidéomicroscopie à fluorescence,
- Microscope à force atomique (AFM),
- Microscope holographique numérique (DHM),
- Microscope de tomographie optique cohérente (OCT),
- Station d’imagerie de bioluminescence,
- Banc d’analyse en lumière polarisée.
Microscopie pour la biophysique (LIPhy) :
- Microscope biphotonique droit avec optique adaptative et FCS (680 à 1080 nm),
- Microscope à feuille de lumière,
- Microscope FCS et multi-FCS (488 et 637 nm),
- Microscope pour multi-FRAP, multi-photoactivation, photoinactivation et mesure de forces de traction,
- Microscope confocal pour l'optique adaptative et la FCS (561 nm),
- Spectrofluorimètre en absorption (250 à 1000 nm) et fluorescence (290 à 850 nm),
- Microscope à force atomique couplé à un microscope inversé en milieu liquide.
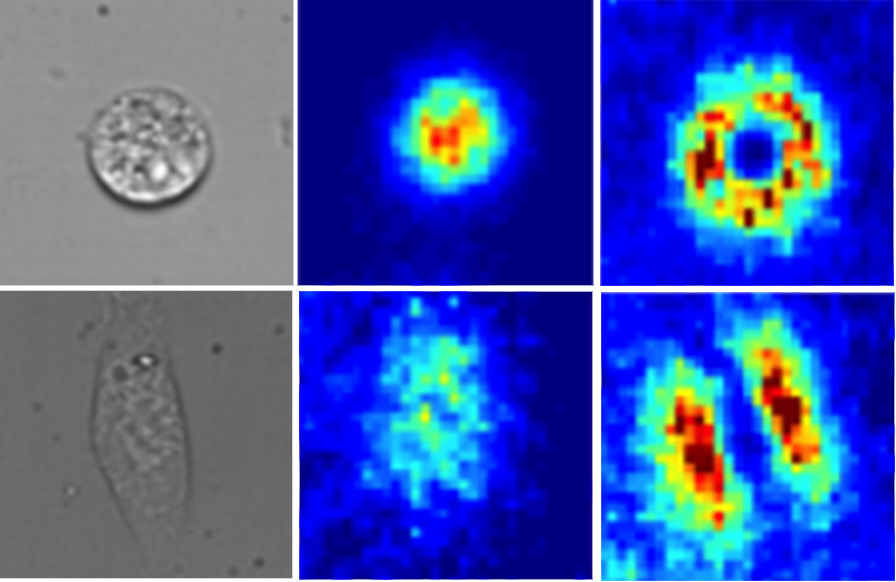
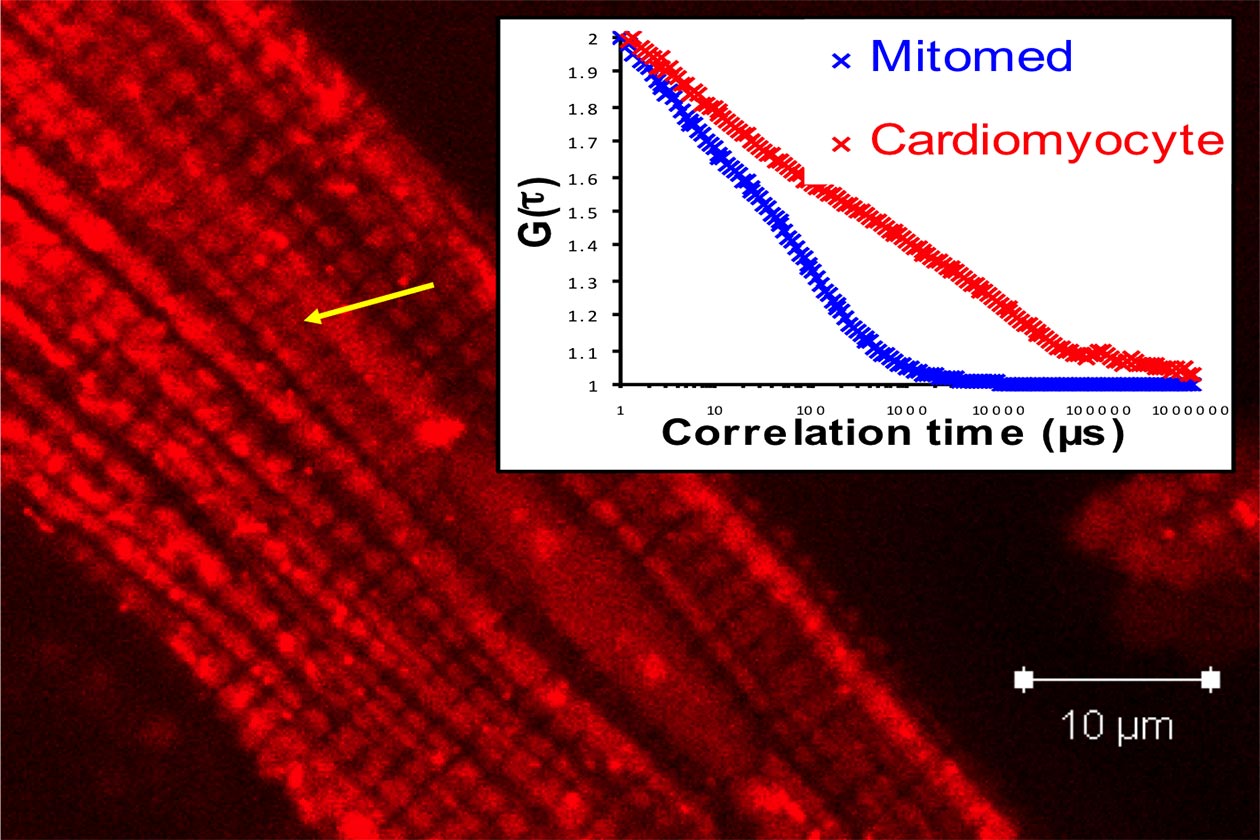
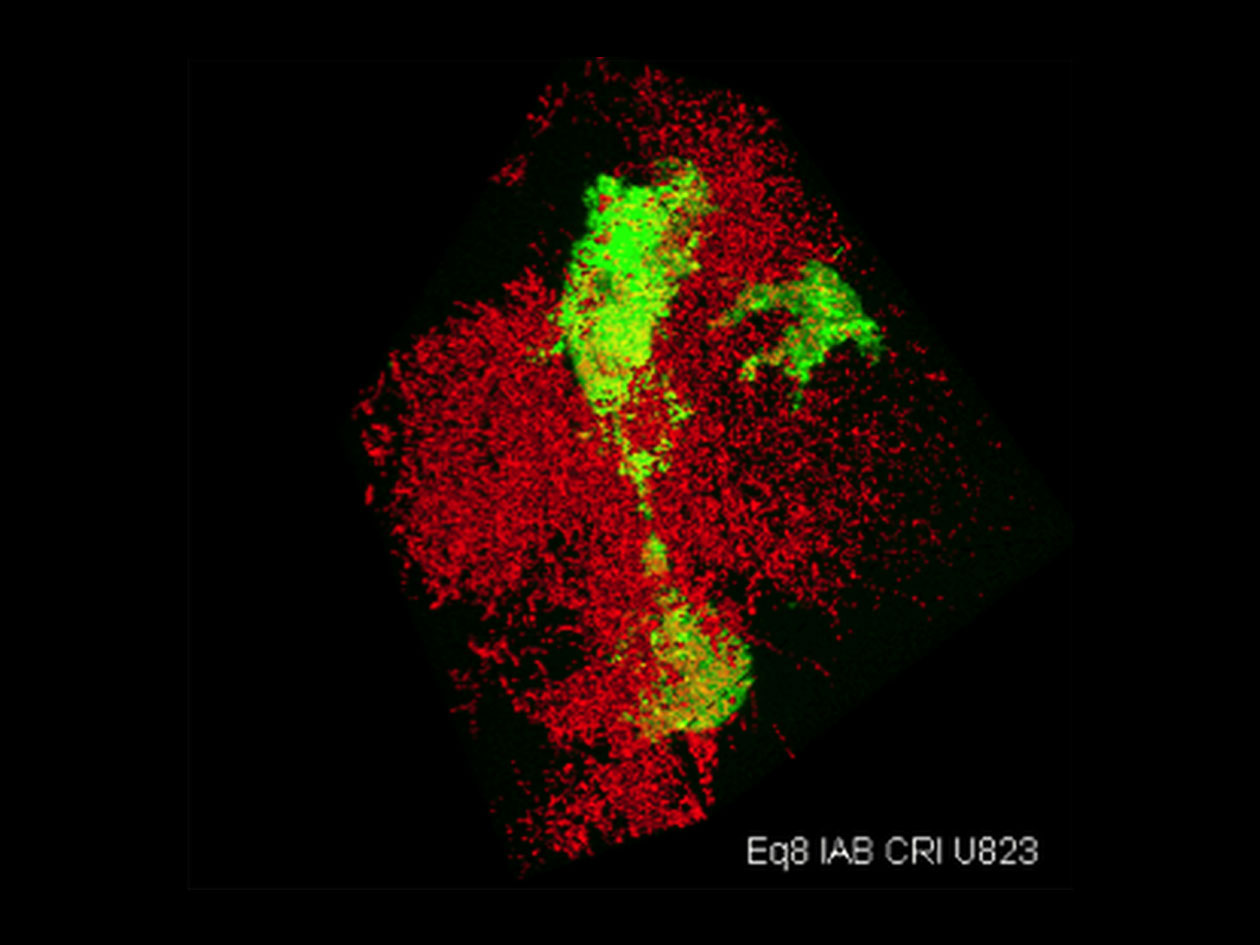
Comment soumettre un projet ?
Pour soumettre un projet à ISdV-In vitro, vous pouvez remplir le formulaire de contact mis à votre disposition sur le site internet de la plateforme. Décrivez votre projet et vos besoins en matière de microscopie. L’équipe d’ISdV-In vitro vous recontactera pour étudier avec vous la faisabilité de votre projet et la nature des services que la plateforme peut vous offrir. Une réponse vous sera adressée dans la semaine qui suit.
Contact
ISDV-In vitro
c/o Karin Pernet-Gallay
Grenoble institut des neurosciences
Chemin Fortuné Ferrini
38706 La Tronche
Région : Auvergne-Rhône-Alpes +33 (0)4 56 52 05 20
+33 (0)4 56 52 05 20
karin.pernet-gallay@univ-grenoble-alpes.fr
Site de la plateforme
THÉMATIQUES : Imagerie cellulaire
RESPONSABLES SCIENTIFIQUES :
Karin Pernet-Gallay
TUTELLES : CHU de Grenoble, CNRS, Inserm, Université Grenoble Alpes
INFRASTRUCTURES NATIONALES : France BioImaging
LABELLISATION IBiSA : 2009
MOTS CLÉS : Microscopie quantitative, Optogénétique, Photomanipulation, Optique adaptative, Imagerie de phase, Neurosciences, Traffic intracellulaire, Vascularisation cérébrale, Cytosquelette, Analyse d’images, Développement instrumental
Fiche mise à jour en 2025










