Bioressources : imagerie, biochimie et structure (BIBS)
Analyse et caractérisation de bioressources et bioproduits, de la molécule à l'objet, pour l'alimentation, la santé et la bioéconomie.
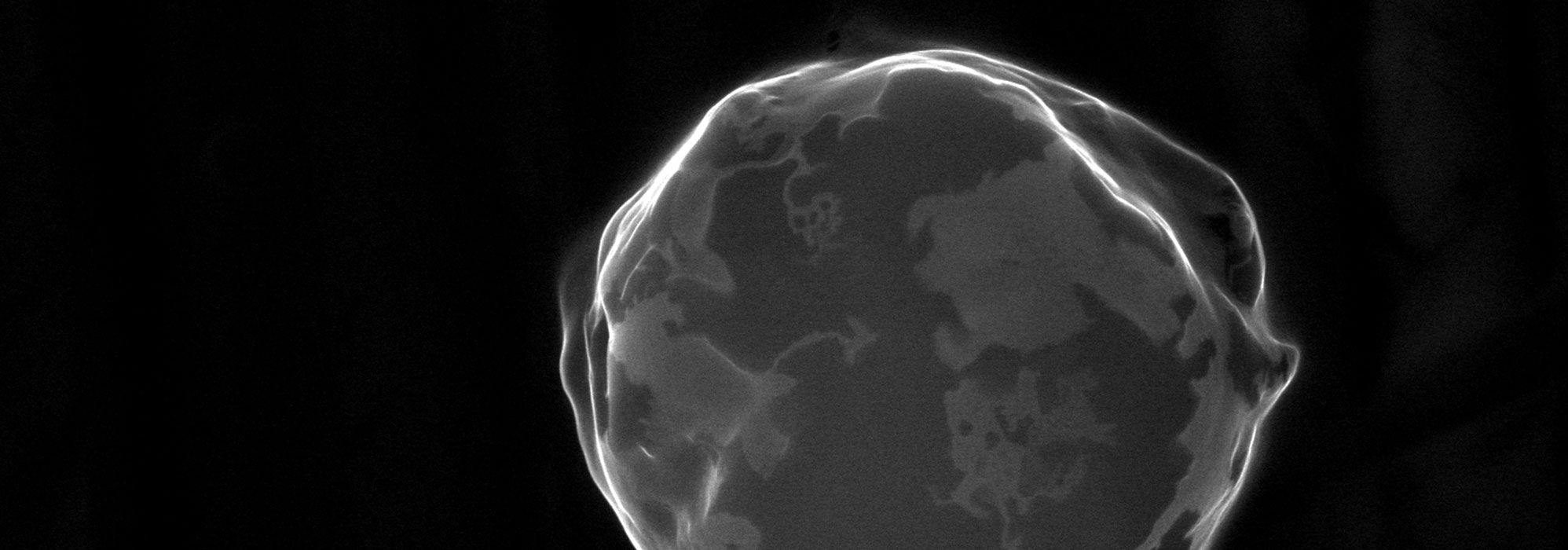
Bioressources : imagerie, biochimie et structure (BIBS)
Analyse et caractérisation de bioressources et bioproduits, de la molécule à l'objet, pour l'alimentation, la santé et la bioéconomie.
Bioressources : imagerie, biochimie et structure (BIBS)
BIBS développe et propose des méthodes et des expertises pour la caractérisation physicochimique des bioressources et bioproduits, de la molécule à l'objet. Les systèmes étudiés sont issus de ressources agricoles ou marines, naturelles ou transformées. Ils sont notamment composés d’une variété de biopolymères, polysaccharides cellulosiques et non cellulosiques, amidon, lipides, protéines… Les analyses fournies par BIBS ciblent ces biopolymères et visent à montrer comment la composition, les structures et les différents niveaux d'interaction et d'organisation de ces biopolymères affectent la valeur d’usage des systèmes étudiés. Le terme « valeur d’usage » comprend les propriétés fonctionnelles, technologiques, nutritionnelles ou biologiques, et cible différentes utilisations finales dans le domaine de l'industrie agroalimentaire, des sciences végétales et marines, de la santé, de la cosmétique et de la chimie verte.
La spécificité de BIBS est ainsi de déployer des méthodes complémentaires en termes d’échelle et d’information, dans le but d'explorer les systèmes de manière intégrative. Les expertises analytiques et de traitement numérique des données s’accompagnent d’une large expertise des bioressources et bioproduits étudiés en lien avec leurs usages. La plateforme donne plus précisément accès à une gamme complète de techniques et de compétences en résonance magnétique nucléaire (RMN), microscopie, spectrométrie de masse (MS), chromatographie et traitement des données, comprenant l'analyse de spectres, de données et d'images.
Expertises et services
- Identification et quantification de biopolymères d’intérêt,
- Caractérisation de la structure fine de biopolymères,
- Criblage de bioressources et bioproduits sur des caractéristiques de composition et de structure de biopolymères d’intérêt,
- Observation et localisation de biopolymères et de macrostructures à différentes échelles,
- Etude de la dynamique et des interactions moléculaires : porosité, diffusion, mobilité...
Moyens et équipements
Microscopes :
- Microscope à force atomique (Bruker) couplé à un microspectromètre Raman (Renishaw),
- Microscope électronique à transmission (Jeol),
- Microscope électronique à balayage environnemental Quattro S (Thermo),
- Microscope confocal à balayage laser (Nikon).
Spectromètres :
- Spectromètre RMN haut champ Avance NEO 9.4T WB (Bruker),
- Spectromètres RMN bas champ MiniSpec mq20 0.47T (Bruker),
- Trappe ionique Amazon SL (Bruker),
- Select Series Cyclic IMS (Waters),
- RapifleX Tissuetyper (Bruker),
- Q-Exactive HF (Thermo).
Chromatographes :
- Trace GC Ultra et Trace GC-ISQ (Thermo),
- HPAEC, ICS 6000 (Thermo),
- HPSEC-RALS-LALS (Malvern),
- Acquity ELSD Fluo SQD2 (Waters),
- Détecteurs MS, FID, MALS, PAD et Fluo.
Equipements de préparation :
- Préparations biochimiques : extracteurs ASE 350 (Thermo), automate de préparation (Chemspeed technologies),
- Préparation pour l’imagerie : métalliseur, cryoplongeur, dessicateur par contournement de point critique et ultramicrotome (Leica), microtome et vibratome (Microm).
Solutions numériques :
- Logiciels pour l’interprétation et l’annotation des spectres,
- Outils pour le recalage, la fusion et l’analyse d’images,
- Méthodes d’exploration non supervisée de la structure interne des données
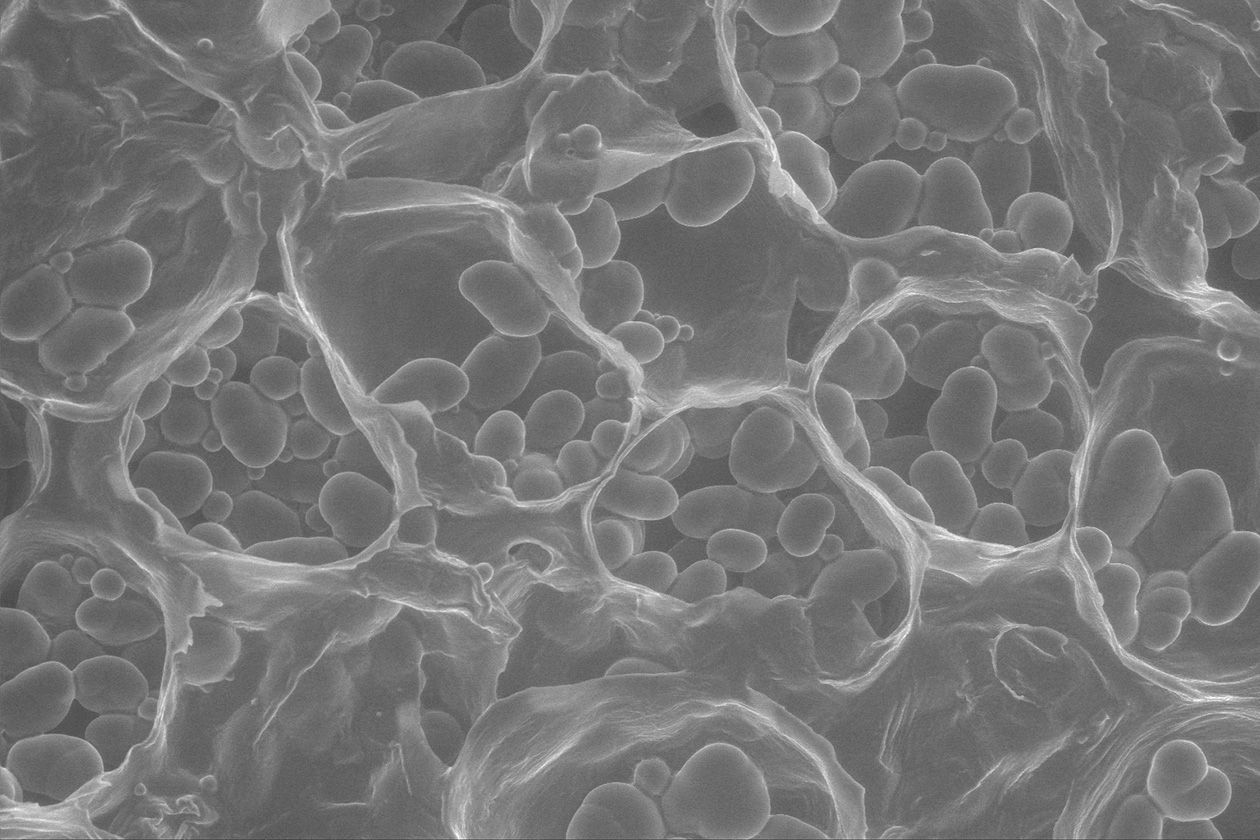

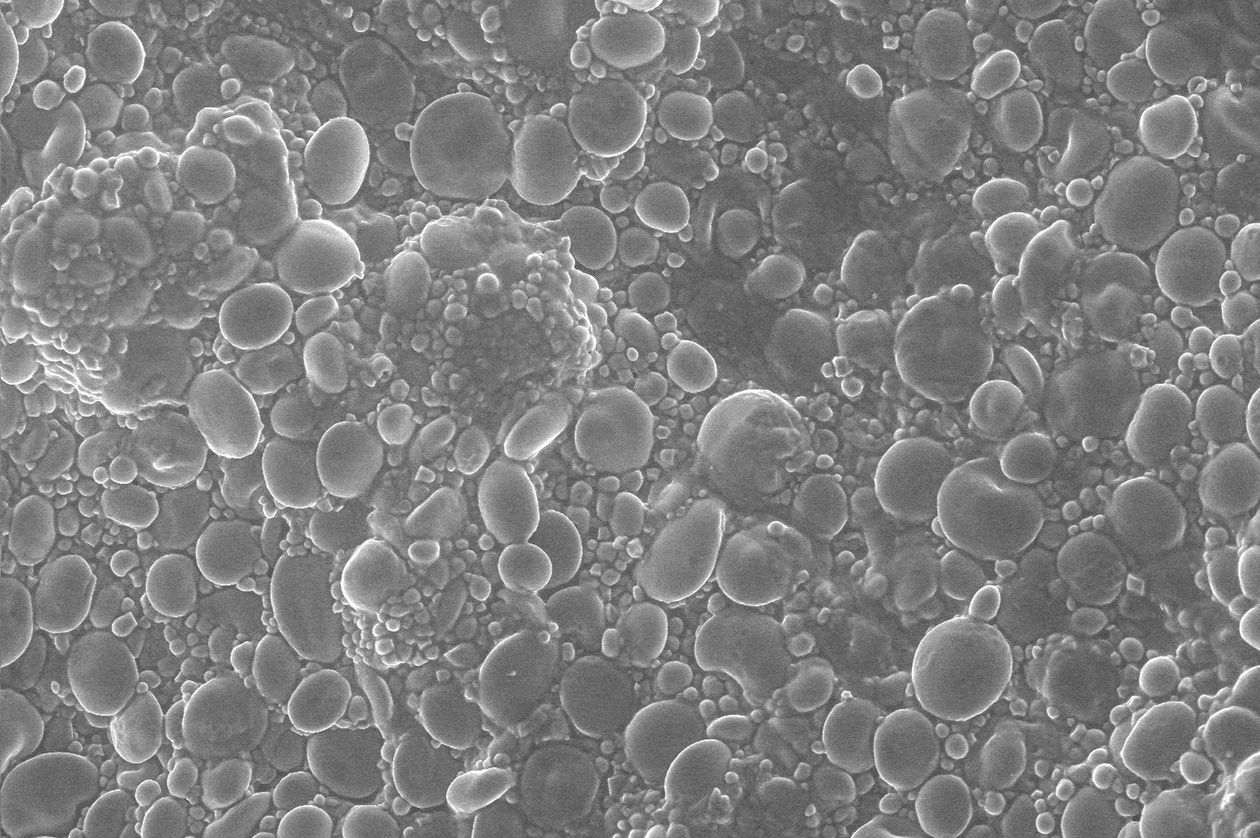






Comment soumettre un projet ?
La plateforme BIBS est ouverte à la communauté scientifique, académique et privée. Elle apporte son appui à l'analyse et au traitement de données sous la forme de prestations de service ou de collaborations. S’ils s’avèrent nécessaires au projet, des développements de méthodes peuvent être envisagés en collaboration. L’habilitation d’utilisateurs est également possible sur certains équipements.
Adressez votre demande à la plateforme par mail à l’adresse contacts-bibs@inrae.fr. Décrivez brièvement votre projet et la problématique posée. L’adéquation de la demande à l’expertise technique et scientifique de la plateforme est étudiée par les différents responsables des composantes analytiques de BIBS. Une réponse vous est envoyée dans un délai d’une à deux semaines. Si le projet peut être pris en charge par la plateforme, la réponse s’accompagne d’une proposition de stratégie analytique, d’un devis et d’une planification.
Exemple d'utilisation
Qualification de nouvelles enzymes fongiques actives sur des polysaccharides (LPMO) par la caractérisation fine de leurs produits de réaction
Les monooxygénases polysaccharidiques lytiques (LPMO) représentent une nouvelle classe d’enzymes prometteuses pour prétraiter la biomasse végétale et améliorer les rendements de conversion de la lignocellulose dans la filière des biocarburants et en chimie verte. Le laboratoire Biodiversité et biotechnologie fongiques (BBF), porteur du projet soumis à la plateforme BIBS, mène des recherches sur les stratégies enzymatiques développées par les champignons filamenteux. Il a identifié plusieurs candidats à activité LPMO.
Dans ce contexte, BIBS a effectué différents types d’analyses, par spectrométrie de masse, RMN du solide et chemotypage. Les résultats ont aidé le BBF à qualifier les activités LPMO criblées dans la biodiversité fongique. Ils ont affiné les connaissances sur le mode d'action de ces enzymes, en déterminant la structure fine des produits libérés dans le milieu réactionnel à partir de différentes sources de LPMO et sur différents types de substrats, cellulosiques ou non. Enfin, les résultats ont fourni des informations structurales et dynamiques sur les changements qui se produisent avant et après l'action des LPMO sur la cellulose, en particulier sur la modification de la cristallinité et l'identification des sites d'interaction.
Pour en savoir plus : Filiatrault-Chastel C. et al. (2019). AA16, a new lytic polysaccharide monooxygenase family identified in fungal secretomes. Biotechnology for Biofuels, 12:55.
Contact
BIBS
Biopolymères, interactions, assemblages (BIA), UR1268
Centre INRAE Pays de la Loire
La Géraudière
44300 Nantes
Région : Pays de la Loire +33 (0)2 40 67 50 98
+33 (0)2 40 67 50 98
contacts-bibs@inrae.fr
Site de la plateforme
THÉMATIQUES : Biologie structurale, biophysique, biochimie, Imagerie cellulaire
RESPONSABLES SCIENTIFIQUES :
Sophie Le Gall
RESPONSABLES TECHNIQUES :
David Ropartz, Catherine Deborde, David Legland, Bruno Novales
RESPONSABLES QUALITÉ :
Loric Thoulouze
TUTELLES : INRAE
INFRASTRUCTURES NATIONALES : CALIS, Phenome-Emphasis France, PROBE
LABELLISATION IBiSA : 2010
MOTS CLÉS : Biopolymères, Assemblages, Composition, Structure, Localisation, Multi-échelles, Spectrométrie de masse, RMN, Imagerie, Microscopie, AFM, Chemotypage, Analyse d’images, Traitement de données, Système biosourcé, Plantes, Aliments, Matrice alimentaire, Biomatériau, Algue, Paroi
Fiche mise à jour en 2024










