Lyon multiscale imaging center (LyMIC)
Microscopie multidisciplinaire et formation pour l'imagerie multi-échelle du vivant et des matériaux.
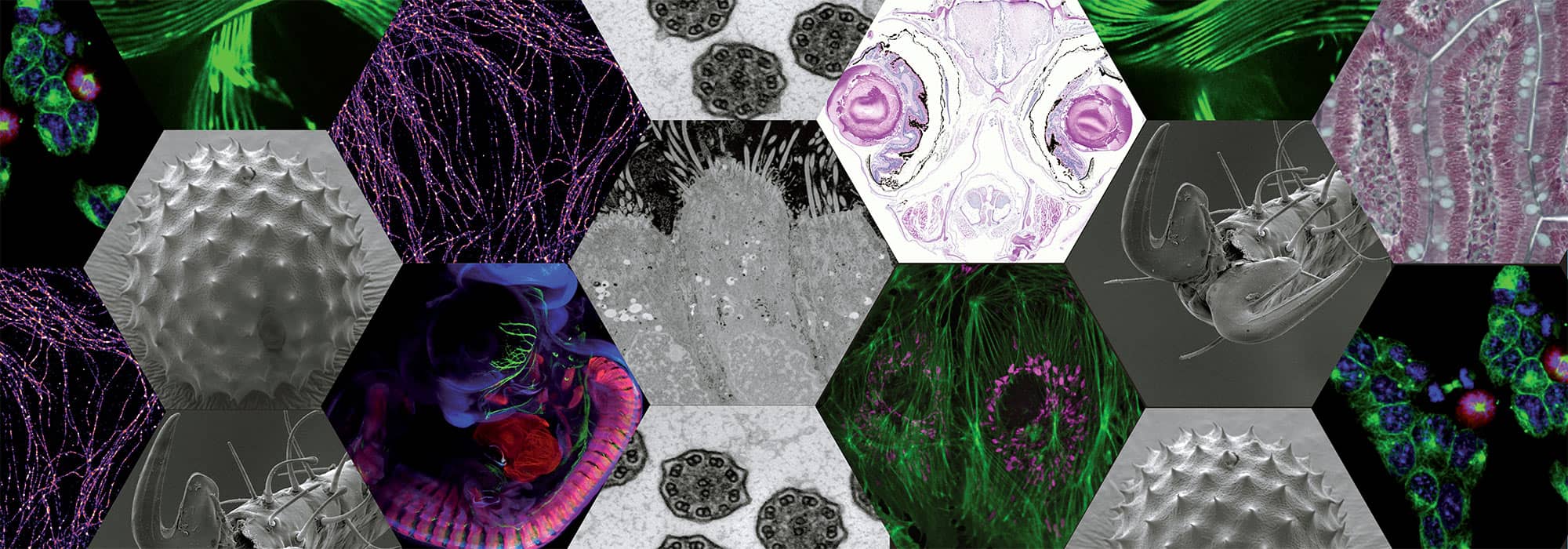
Lyon multiscale imaging center (LyMIC)
Microscopie multidisciplinaire et formation pour l'imagerie multi-échelle du vivant et des matériaux.
Lyon multiscale imaging center (LyMIC)
LyMIC est une plateforme créée à l’initiative de l’Université́ Claude Bernard Lyon 1 pour répondre aux besoins en microscopie des acteurs académiques et industriels régionaux. Elle est également ouverte au niveau national et international. LyMIC coordonne l'activité des trois sites lyonnais de microscopie CIQLE, CTmu et PLATIM et propose un accès à une instrumentation de pointe en microscopie photonique et électronique. Un service d’histologie et d’anatomopathologie, ainsi qu'un service d’impression 3D sont aussi disponibles.
Un personnel qualifié offre aux utilisateurs de la plateforme conseil et assistance pour le montage de leurs projets et l'utilisation des machines. Une longue tradition de service auprès des industriels et des académiques permet également de réaliser des projets complets sur demande. LyMIC propose par ailleurs une offre très riche de formations, initiales et continues, couvrant un large spectre de techniques d'imagerie photonique et électronique et d’analyse d’images.
Expertises et services
Microscopie photonique :
- Microscopie plein champ (fluorescence et transmission),
- Microscopie confocale (possibilité de mesures spectrales, FRET, FRAP et FLIM),
- Microscopie confocale rapide (spinning disk),
- Microscopie biphotonique,
- Microscopie super-résolutive (PALM/STORM et SIM),
- Microscopie à feuille de lumière (SPIM),
- Vidéomicroscopie,
- Assistance et formation sur tous les appareils de la plateforme,
- Mise à disposition de microscopes pour les utilisateurs formés,
- Développement de technologies et mise au point de protocoles,
- Conseil sur le choix des équipements en fonction des échantillons et des questions,
- Organisation de formations continues,
- Analyse de systèmes biologiques variés (virus, bactéries, cellules et tissus animaux et végétaux, sphéroïdes, poissons zèbres, drosophiles, nématodes...),
- Traitement et analyse d'images pour le public et le privé,
Microscopie électronique :
- Microscopie électronique en transmission (TEM, cryo-TEM, HRTEM, STEM),
- Microscopie électronique à balayage (FE-SEM, ESEM, cryo-SEM, EDX),
- Tomographie,
- Microscopie corrélative (CLEM),
- Ombrage rotatif,
- Mise à disposition de microscopes et assistance pour leur utilisation,
- Réalisation d'études à façon,
- Organisation de formations continues,
- Prise en charge d’échantillons biologiques ou matériaux, fixation chimique et inclusion en résine (Epon, LRWhite, Lowicryl),
- Ultramicrotomie et cryo-ultramicrotomie (coupes semi et ultrafines),
- Analyse immunocytochimique, anatomopatologique et ultrastructurale.
Histologie-anatomopathologie :
- Réalisation d'études à façon,
- Inclusion d’échantillons et coupe en paraffine,
- Coloration en routine sur automate (HP et HPS),
- Coloration spéciale (trichrome de Masson, crésyl violet, PAS, Gram...),
- IHC sur automate (DAB, anticorps),
- Transparisation d’organes et de tissus par la méthode X-Clarity,
- Conseil et développement de protocoles selon les besoins des utilisateurs,
- Mise à disposition des cryostats et microtomes.
Impression 3D :
- Dessin et modélisation en 3D avec les logiciels SketchUp (Trimble), Fusion 360 (Autodesk) et FreeCAD (FreeCAD),
- Impression de pièces en 3D.
Moyens et équipements
Microscopie photonique :
- Microscope confocal inversé LSM800 avec module Airyscan (Zeiss),
- Microscope confocal avec détection spectrale SP5 (Leica) ,
- Microscope spinning disk avec module de FRAP et photoactivation (Leica-Roper),
- Microscope confocal LSM710 inversé équipé biphoton (Zeiss),
- Microscope confocal LSM700 statif droit pour gros échantillons (Zeiss),
- Microscope confocal CQ1 pour criblage à haut débit (Yokogawa),
- Microscope confocal spinning disk avec module Borealis (Andor),
- Microscope confocal inversé SP5 X (Leica),
- Microscope confocal LSM880 avec module Fast Airyscan (Zeiss),
- Microscope biphoton Ultima (Bruker),
- Microscope à feuille de lumière Lightsheet Z.1 (Zeiss),
- Scanner de lame Axioscan Z1 (Zeiss),
- Microscope de super-résolution N-STORM pour PALM/STORM (Nikon),
- Microscope de super-résolution Elyra 7 pour PALM/STORM et SIM (Zeiss),
- 2 vidéomicroscopes (Zeiss, Nikon),
- 3 mircroscopes à champ large (Zeiss),
- 7 stations de travail avec logiciels Amira, Arivis, Imaris, Huygens, Zen, ImageJ.
Microscopie électronique :
- Microscope électronique en transmission 2100F haute résolution 200 kV (Jeol) avec camera UltraScan 1000 (Gatan),
- Microscope électronique en transmission CM120 120 kV (Philips), camera Orius 200 (Gatan),
- Microscope électronique en transmission M1400 120 kV (Jeol) avec camera Orius 600 (Gatan) et détecteur de microanalyse X JED 2300 (Jeol),
- Microscope électronique à balayage Merlin Compact VP (Zeiss),
- Microscope électronique à balayage Quanta 250 FEG (FEI),
- Unité de cryofixation haute pression HPM100 (Leica),
- 2 automates de cryosubstitution AFS2 (Leica),
- Cryo-ultramicrotomes UC7 et 2 ultramicrotomes UC7 (Leica),
- Cryo-ultramicrotome Ultracut S et 2 ultramicrotomes Ultracut E (Reichert),
- Métalliseurs MED20 (BalTec) et MED10 (Balzers).
Histologie-anatomopathologie :
- Cryostat C3050S (Leica),
- Microtome RM2245 (Leica),
- Microtome automatisé RM2255 (Leica),
- Microtome automatisé HM355S avec CoolCut (Thermo Fisher),
- Cryo-ultramicrotomes UC7 (Leica),
- Automate d’imprégnation ASP300 (Leica),
- Automate d’IHC/HIS Ventana Discovery XT (Roche),
- Automate de coloration AutoStainer XL (Leica),
- Système de transparisation X-Clarity (Logos Biosystems).
Impression 3D :
- Imprimante à dépôt de matière fondue Tobeca 3 (Tobeca),
- Imprimante stéréolithographique Form 2 (Formlabs).



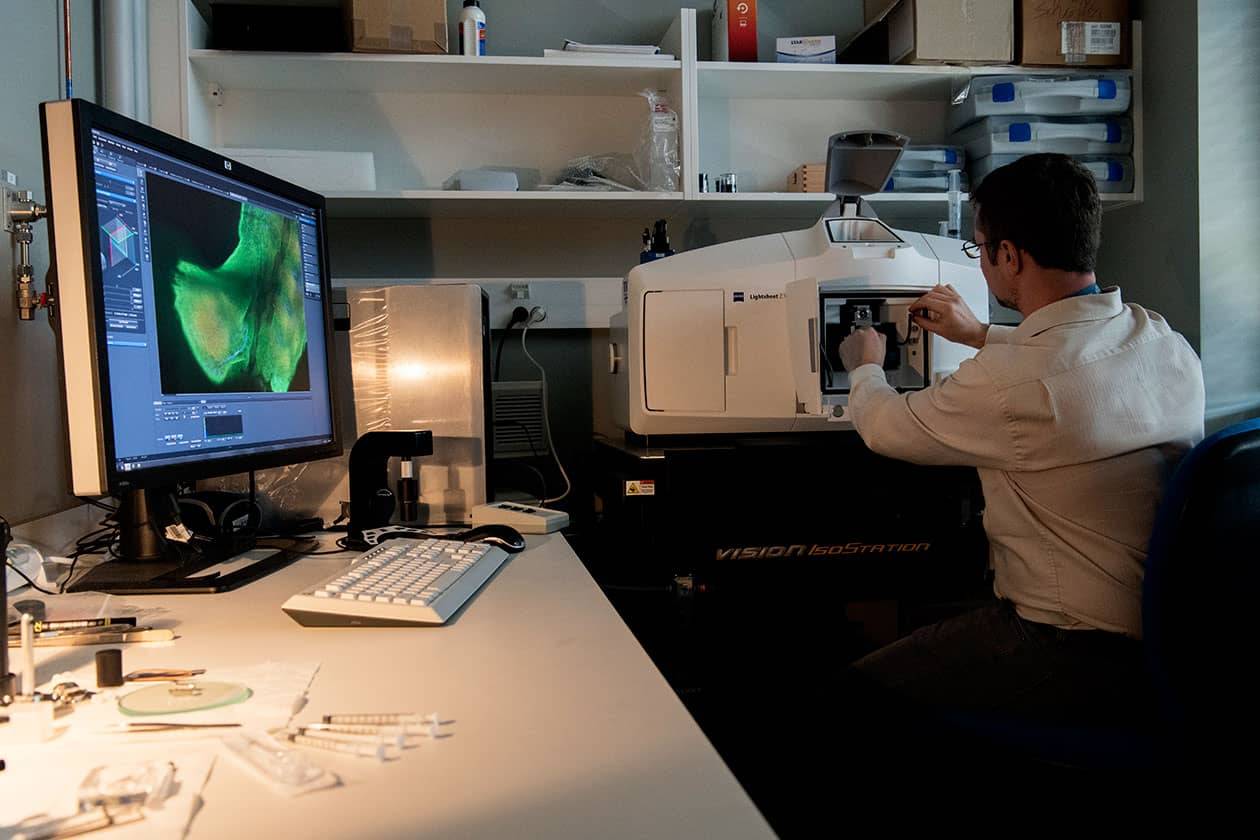

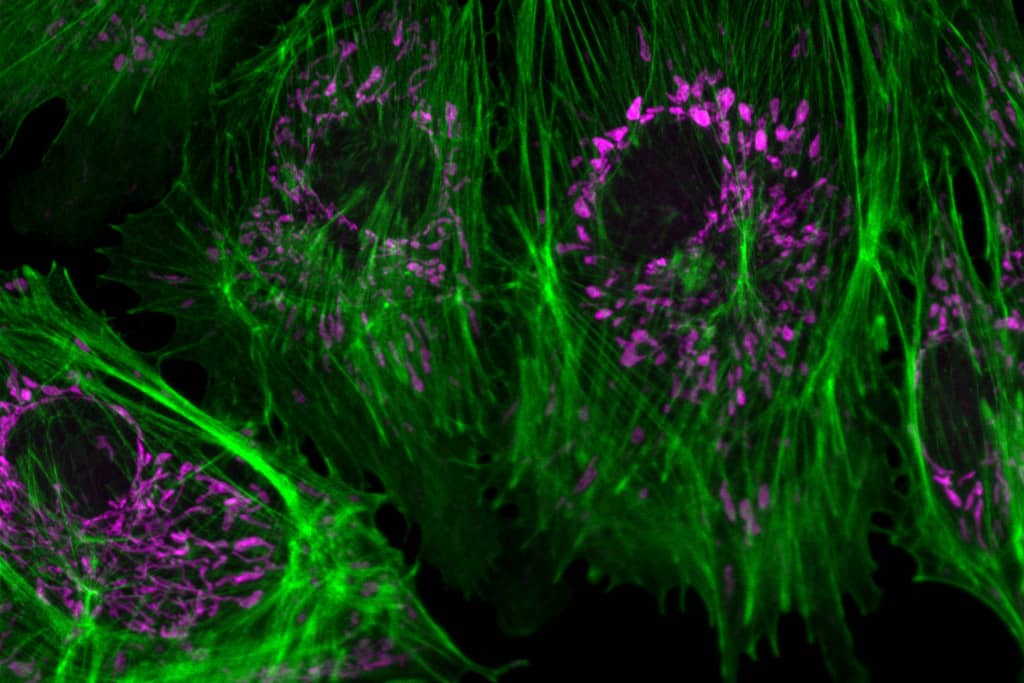










Comment soumettre un projet ?
LyMIC sélectionne les projets sur la base de leur faisabilité, de la disponibilité du personnel et des machines et du respect des règles d'éthiques, d'hygiène et de sécurité.
Pour soumettre une demande, vous devez envoyer un mail avec un descriptif du projet et le délai de réalisation souhaité à la plateforme concernée : Denis Ressnikoff ou PLATIM pour la microscopie photonique, Elisabeth Errazuriz-Cerda ou Xavier Jaurand pour la microscopie électronique et l’anatomopathologie, PLATIM pour la microscopie à force atomique, Annabelle Bouchardon pour l’histologie, ou Bruno Chapuis pour l’impression 3D.
L'exécution de prestations complètes requiert une étude de faisabilité et la rédaction d’un cahier des charges par le service prestations. Certains projets de développement technologique sont sélectionnés par un comité sur la base de l'intérêt scientifique et technologique et de l'intérêt pour une diffusion des techniques aux autres utilisateurs.
Exemple d'utilisation
Etude de l’assemblage des cils chez la drosophile
L’équipe « Assemblage des cils et développement » de l’Institut NeuroMyoGène a bénéficié des compétences complémentaires en imagerie de la plateforme LyMIC pour comprendre les étapes initiales de l’assemblage des cils chez un organisme modèle, la drosophile. L’une des difficultés à résoudre pour atteindre cet objectif était de pouvoir déterminer la localisation précise des protéines impliquées dans ces étapes initiales et de corréler leur présence à l’assemblage et à la dynamique de structures ciliaires spécifiques.
En combinant des approches d’imagerie à haute résolution (3D-SIM), des observations sur des échantillons vivants (microscopie confocale rapide, spinning disk) et des observations en microscopie électronique en transmission, les chercheurs sont parvenus à montrer le rôle primordial que joue un groupe de protéines dans l’assemblage de la zone de transition, une structure particulière située à la base des cils. Cette étude a également révélé comment le compartiment membranaire de la zone de transition est nécessaire pour contrôler l’initiation de la croissance des cils dans les cellules germinales mâles de la drosophile.
Pour en savoir plus : Vieillard J. et al. (2016). Transition zone assembly and its contribution to axoneme formation in Drosophila male germ cells. Journal of Cell Biology, 214(7):875–889.
Contact
LyMIC
SFR Santé Lyon-Est
CNRS UMS3453 / Inserm US7
Faculté de médecine Lyon-Est
8 Avenue Rockefeller
69373 Lyon Cedex 08
Région : Auvergne-Rhône-Alpes +33 (0)4 78 77 87 81
+33 (0)4 78 77 87 81
lymic@univ-lyon1.fr
Site de la plateforme
THÉMATIQUES : Histologie, anatomopathologie, Imagerie cellulaire, Imagerie in vivo, radiobiologie
RESPONSABLES SCIENTIFIQUES :
Jean-Louis Bessereau
RESPONSABLES TECHNIQUES :
Xavier Jaurand
TUTELLES : CNRS, ENS Lyon, Inserm, Université Claude Bernard Lyon 1
LABELLISATION IBiSA : 2013
MOTS CLÉS : Imagerie cellulaire, Imagerie de tissus et d’organes, Imagerie de nanomatériaux, Imagerie photonique, FRET, Imagerie à feuille de lumière, Super-résolution, SIM, PALM/STORM, Microscopie électronique en transmission, Microscopie électronique à balayage, Cryo-EM, STEM-HAADF, CLEM, Tomographie, Cryo-ultamicrotomie, Histologie, Transparisation d’organes et tissus, Analyse ultrastructurelle, Analyse anatomopathologique, Immunohistochimie sur automate, Impression 3D, Analyse d’images
Fiche mise à jour en 2021










