PRIMACEN
Un continuum depuis la synthèse peptidique et la préparation d'échantillons jusqu'à la localisation et la détermination de l'activité biologique de molécules d'intérêt par imagerie cellulaire et méthodes de criblage.
PRIMACEN
Un continuum depuis la synthèse peptidique et la préparation d'échantillons jusqu'à la localisation et la détermination de l'activité biologique de molécules d'intérêt par imagerie cellulaire et méthodes de criblage.
Plateforme de recherche en imagerie cellulaire de Normandie (PRIMACEN)
La plateforme PRIMACEN est composée d’un pôle d’imagerie cellulaire intégré à France BioImaging et d’un pôle de pharmacochimie des peptides.
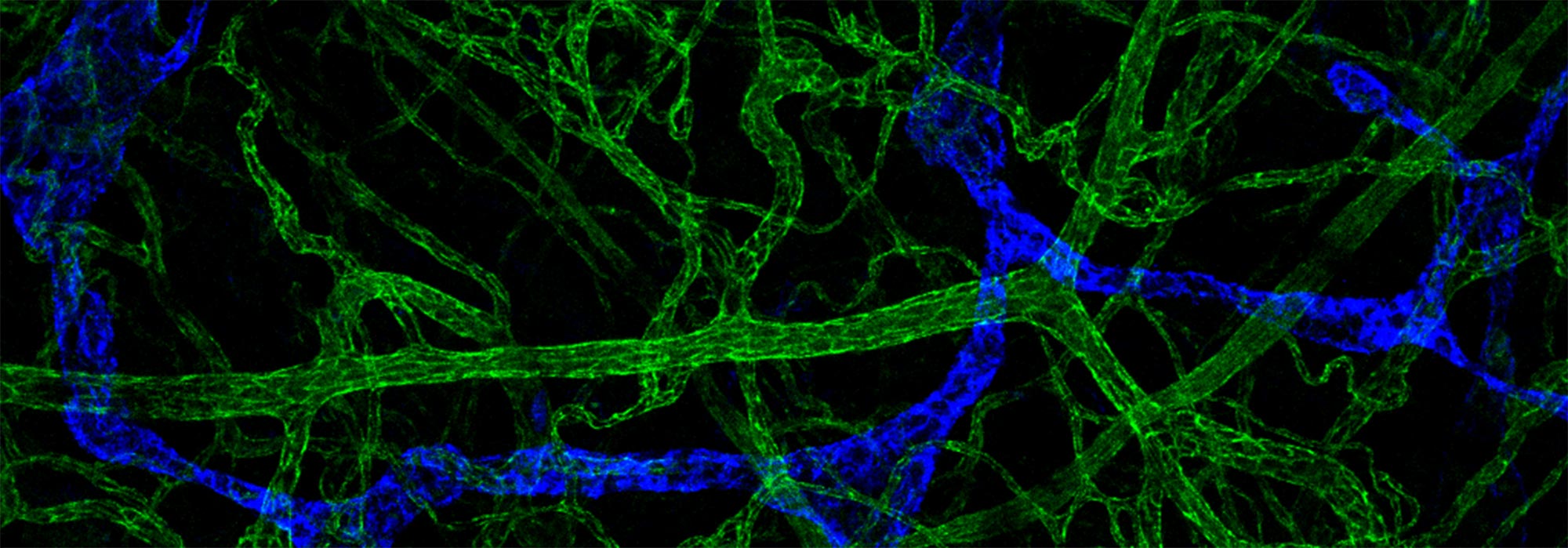
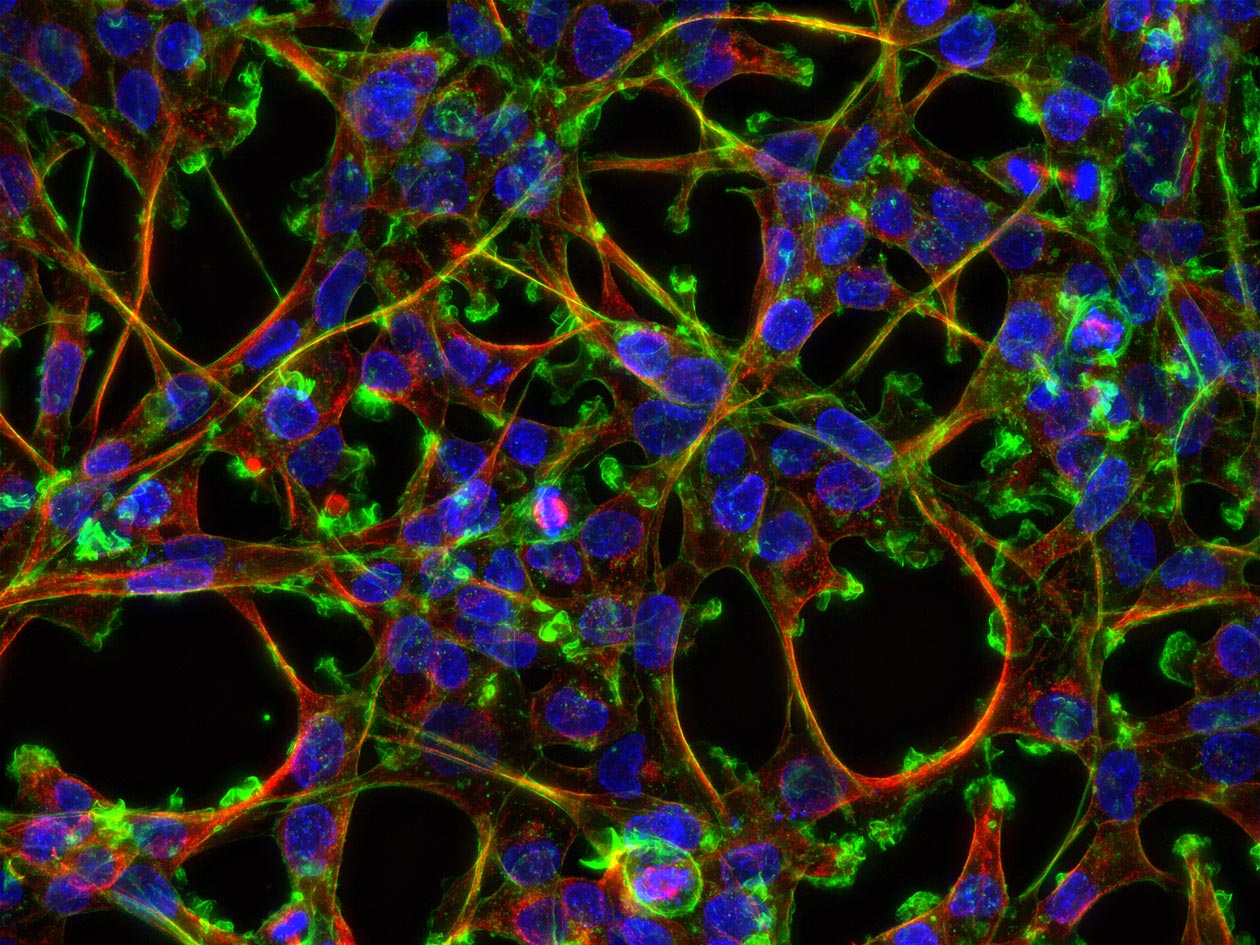
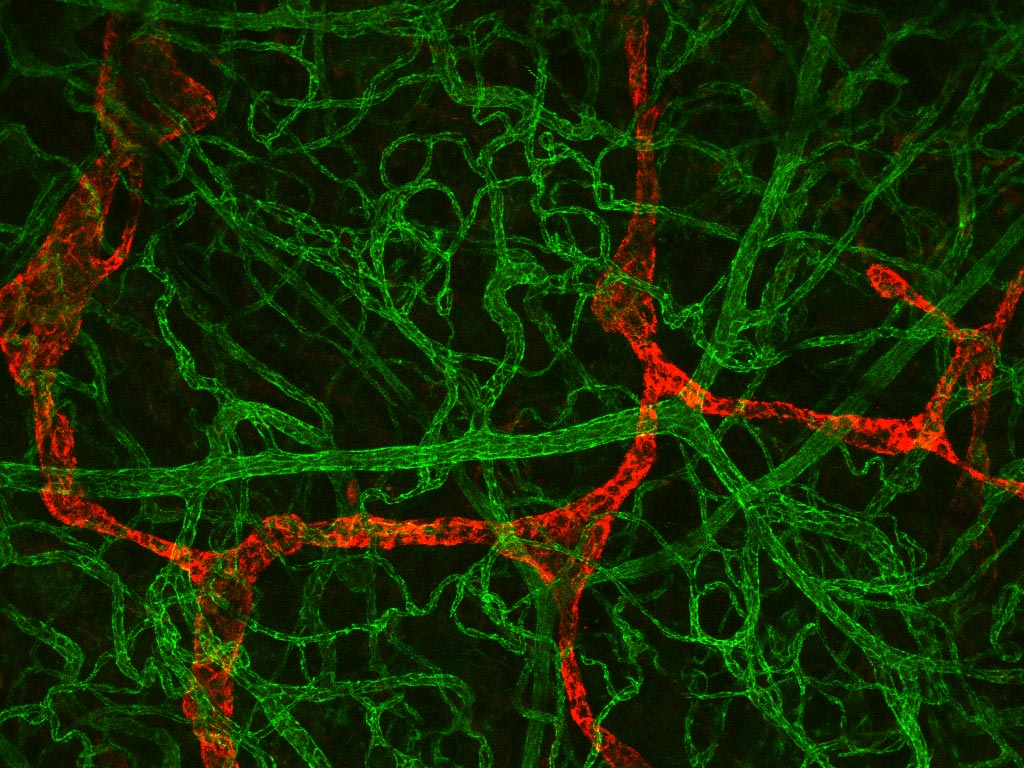
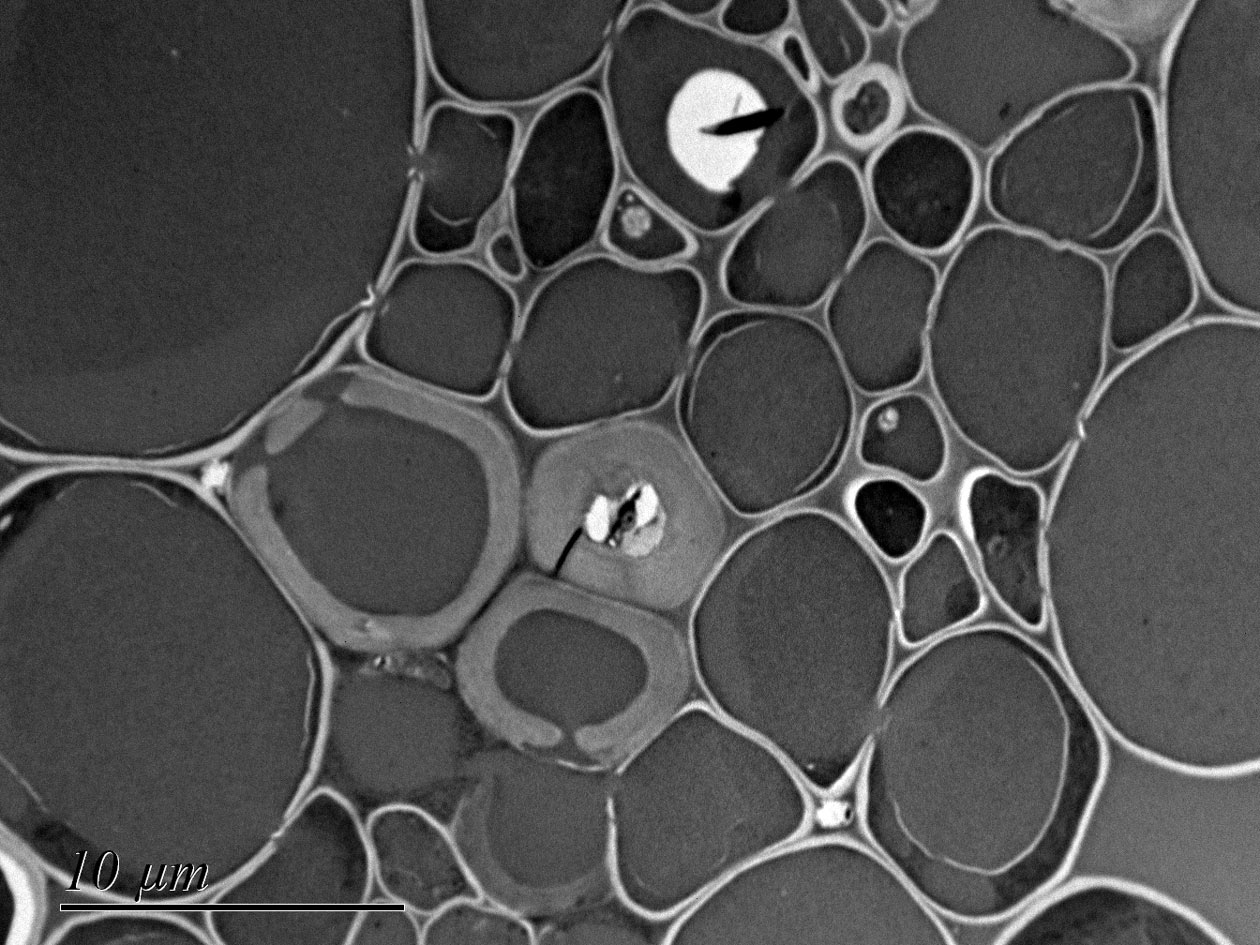
En bioimagerie photonique, PRIMACEN propose des équipements de microscopie (champ large, à ondes évanescentes, confocale, gated STED, FLIM, multiphotonique), de mésoscopie (feuille de lumière) et de macroscopie (champ large et confocale), afin de couvrir un large spectre de résolutions multidimensionnelles. La plateforme offre par ailleurs des solutions d'analyse d'image incluant la segmentation classique ou par intelligence artificielle des objets d’intérêt, le tracking, la déconvolution et la reconstruction 3D. Elle dispose également d’équipements complémentaires dans le domaine de la microscopie électronique en transmission (RT et cryo), avec la préparation d'échantillons en cryofixation à haute pression ou par plongée, par substitution à froid, combinée à l’ultramicrotomie (RT et cryo). De plus, des approches de microscopies corrélatives (CLEM) en mode RT et cryo sont actuellement en cours de développement.
Le pôle de pharmacochimie des peptides offre quant à lui un workflow complet depuis la synthèse, la purification et l’analyse par spectrométrie de masse de peptides d’intérêt, d'analogues peptidiques ou de biomarqueurs, jusqu’au criblage potentiel de leur activité cellulaire par spectrofluorimétrie.
Expertises et services
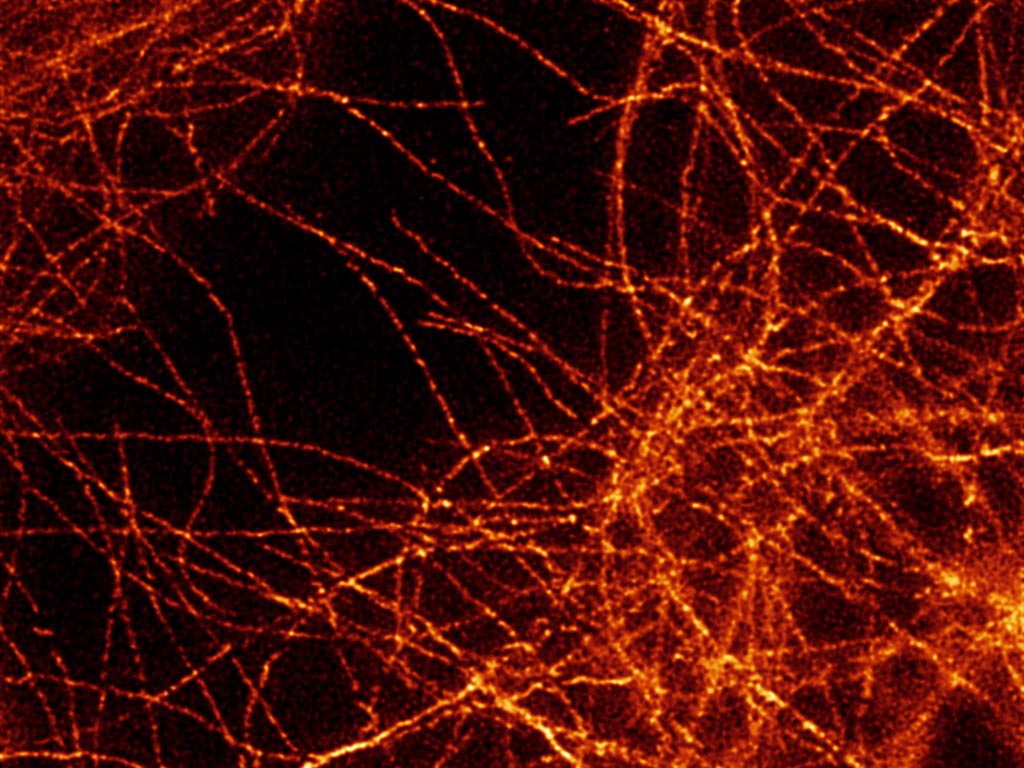
- Imagerie de fluorescence à haute et super-haute résolution spatiale et temporelle,
- Imagerie de temps de vie de fluorescence,
- Microscopie électronique à transmission et cryométhodes,
- Développement à façon de solutions d’analyse d’images,
- Développement d’outils peptidiques pharmacologiques, thérapeutiques et diagnostiques,
- Réalisation de bioessais de signalisation, prolifération et apoptose cellulaire,
- Développement d’applications de gestion informatisée.
Moyens et équipements
Pôle d'imagerie cellulaire :
- 3 macroscopes : confocal et champ large LSI (Leica), Axio Zoom (Zeiss) et Z6 APO (Leica),
- 2 microscopes à feuille de lumière : Blaze Milteny (Biotec) et α3 Facility Edition (Phase View),
- 6 microscopes plein champ : Axiovert fluo, Axioscope 7, Thunder Tissue 3D (Leica), système automatisé Cell Discoverer 7 (Zeiss) et microscope plein champ TIRF multicouleurs (Evident),
- 4 microscopes confocaux : microscope droit SP8 MP (Leica) avec laser pulsé infrarouge Chameleon (Coherent), microscope inversé gated STED SP5 X (Leica) avec laser blanc, microscope inversé FLIM STED Stellaris 8 (Leica) et cryo-CF FLIM Stellaris 8 (Leica),
- Microscope électronique en transmission Talos F200C (Thermo Fisher), cryofixateur à haute pression HPM100, automate de cryosubstitution AFS2, automate de fixation et d’enrésinement EM-TP2 et automate de cryofixation par plongée EM GP2 (Leica),
- 4 ultramicrotomes : UC6, UC7, UC7-cryo et UCT (Leica),
- Cryomicrotome CM1950 (Leica) et 2 vibratomes VT1000 et 1200 (Leica),
- 2 salles de culture cellulaire équipées pour l'animal et le végétal, aquarium avec eau de mer pour les organismes marins et armoire ventilée pour l’hébergement ponctuel de rongeurs,
- 5 stations d’analyse d’images comprenant les logiciels Imaris, ImageJ, LAS X, Zen, Huygens et TrueAI.
Pôle de pharmacochimie des peptides :
- 3 synthétiseurs de peptides,
- 5 HPLC,
- Spectromètre de masse MALDI-TOF,
- Analyseur élémentaire,
- 2 lecteurs de plaques FlexStation 3 et Victor 5.










Comment soumettre un projet ?
Vous pouvez adresser une demande d’accès au service de la plateforme concerné à partir du site internet de PRIMACEN, en choisissant parmi les modalités proposées : utilisation autonome, collaboration scientifique ou prestation. Le responsable de service s’engage à traiter votre demande sous 15 jours. Il étudiera la faisabilité de votre projet en tenant compte de son intérêt scientifique, mais aussi de la disponibilité des ressources humaines et matérielles sur la plateforme. Il définira en particulier un mode d’accès aux postes de travail selon la nature de la demande, la durée et les exigences techniques du projet, la disponibilité du service ou de ses acteurs, les priorités en matière de R&D définies en conseil de gestion, les compétences techniques et l’appartenance administrative du demandeur.
Le responsable de service vous informera de la faisabilité de votre projet puis formalisera dans un cahier des charges les conditions de sa réalisation. La demande sera effective après acceptation du cahier des charges proposé et du règlement intérieur du service concerné.
Exemple d'utilisation
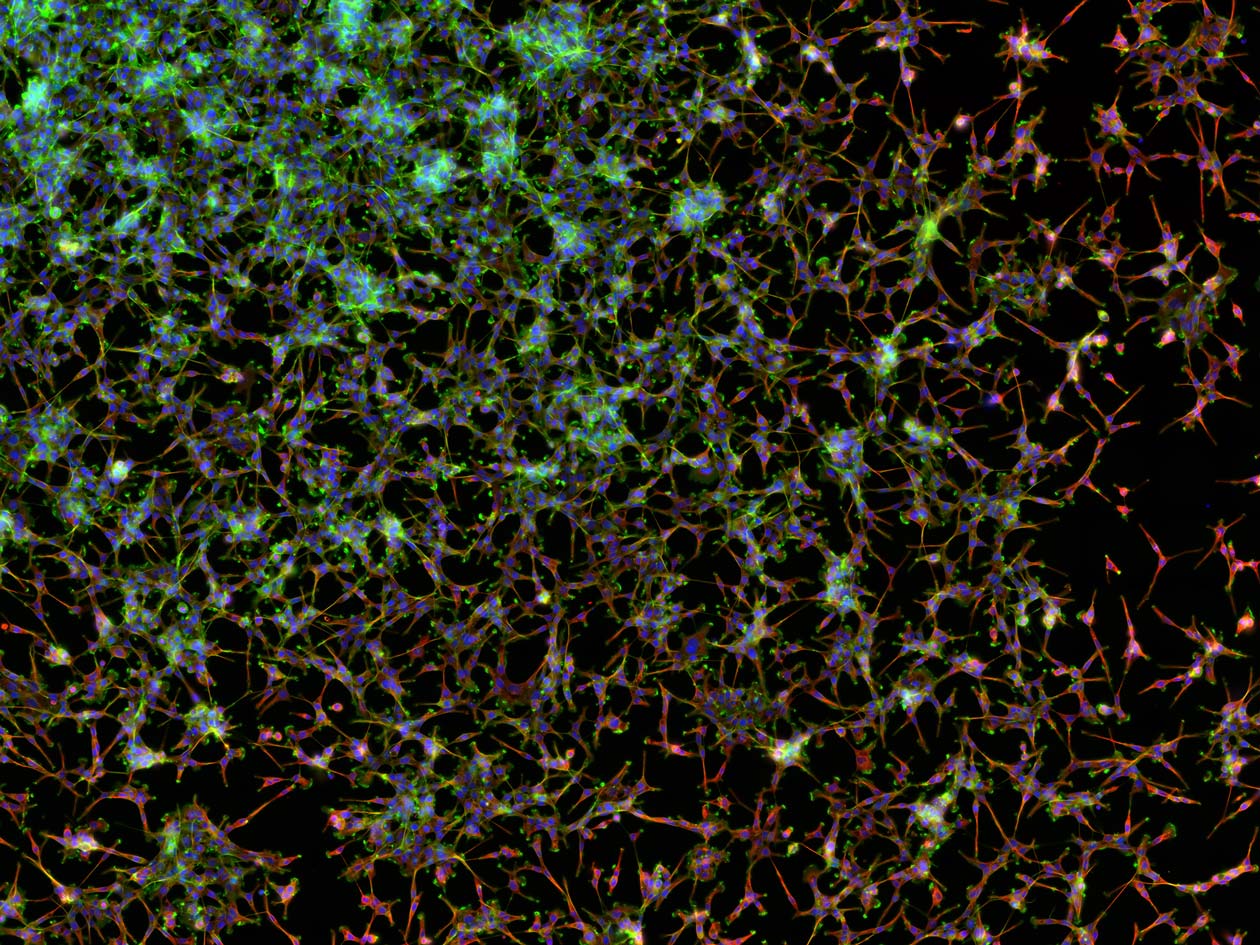
Analyse de microalgues pour la production de biocarburants
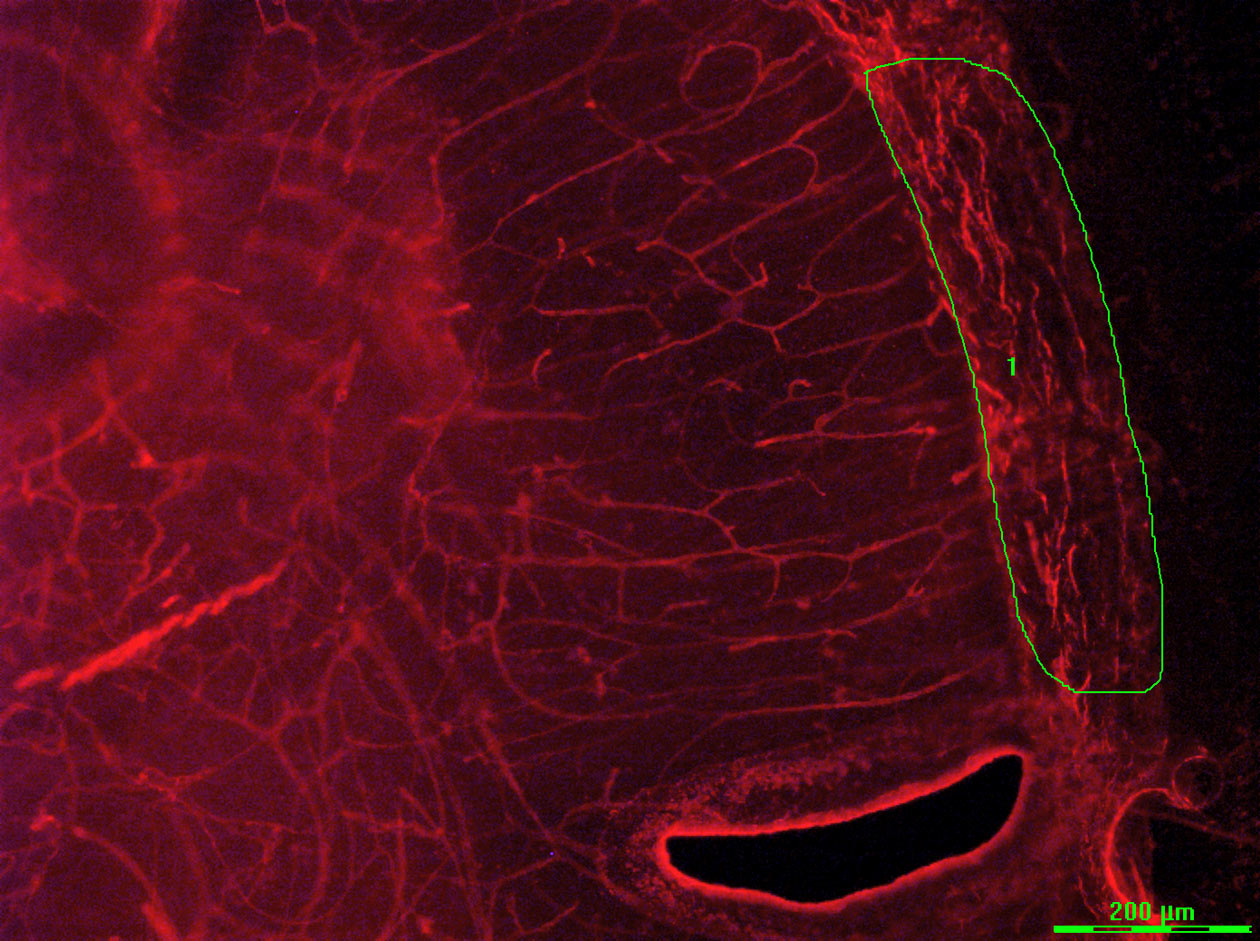
Les microalgues sont des microorganismes photosynthétiques pouvant accumuler jusqu'à 69 % de leur biomasse sous la forme de lipides, ce qui en fait une matière première possible pour la production de biocarburants. Les laboratoires universitaires Boshe et GlycoMEV à Laval, Le Mans et Rouen avaient pour objectif de comparer le métabolisme et les gouttelettes lipidiques de deux écotypes de microalgues.
Les caractéristiques de ces deux écotypes ont été étudiées sur la plateforme PRIMACEN par une combinaison d’approches de microscopie plein champ (CD7 Zeiss), de microscopie confocale à balayage laser (STELLARIS 8 Leica) et d’analyse d’images (ImageJ, Huygens, Imaris). Ces méthodes ont notamment permis d'évaluer le volume cellulaire et la localisation subcellulaire des gouttelettes de lipides et du chloroplaste.
Les résultats obtenus ont montré que les deux écotypes ont adopté des stratégies distinctes concernant la répartition des lipides accumulés, en lien avec le volume cellulaire et le choloroplaste comme source de production de lipides neutres.
Pour en savoir plus : Murison V. et al. (2023). Comparison of two Phaeodactylum tricornutum ecotypes under nitrogen starvation and resupply reveals distinct lipid accumulation strategies but a common degradation process. Frontiers in Plant Science, 14:1257500.
Contact
PRIMACEN
HeRacLeS, US51, UAR2026
Centre universitaire de recherche et d’innovation en biologie (CURIB)
25 rue Tesnière
76821 Mont-Saint-Aignan
Région : Normandie +33 (0)2 35 14 70 48
+33 (0)2 35 14 70 48
contact@primacen.fr
Site de la plateforme
THÉMATIQUES : Imagerie cellulaire, Autres
RESPONSABLES SCIENTIFIQUES :
Ludovic Galas
RESPONSABLES TECHNIQUES :
Magalie Bénard, Sophie Bernard, Jérôme Leprince
RESPONSABLES QUALITÉ :
Ludovic Galas, Magalie Bénard
TUTELLES : Inserm, Université de Rouen Normandie
LABELLISATION IBiSA : 2008
MOTS CLÉS : Synthèse peptidique, Bioassays, Imagerie photonique, Fluorescence, Macroscopie, Microscopie à feuille de lumière, Microscopie biphotonique, 2PM, TIRFM, FLIM, Nanoscopie STED, Microscopie électronique en transmission, Cryométhodes, CLEM, Traitement d'images, Analyse d’images, Sciences vasculaires, Biologie du cancer, Sciences végétales, Biosciences des microalgues, Communication intercellulaire, Neurosciences, Sondes fluorescentes organiques
Fiche mise à jour en 2024










