Pasteur Proteopole
Un ensemble intégré de technologies et d’expertises pour la production et l’analyse multi-échelle de macromolécules et d'assemblages biologiques, impliquant en particulier des protéines.
Pasteur Proteopole
Un ensemble intégré de technologies et d’expertises pour la production et l’analyse multi-échelle de macromolécules et d'assemblages biologiques, impliquant en particulier des protéines.
Pasteur Proteopole
Pasteur Proteopole intègre un ensemble complet de technologies et d’expertises de pointe pour la production et l’analyse des macromolécules et des assemblages biologiques, en particulier des protéines. Du fait de sa localisation à l’Institut Pasteur de Paris, les agents pathogènes et la réponse de l’hôte à l’infection constituent des systèmes biologiques importants pour la plateforme. Composée de quatre équipes (production et purification de protéines recombinantes, ingénierie des anticorps, biophysique moléculaire et cristallographie), elle est ouverte à toute autre thématique.
Pasteur Proteopole collabore largement avec la communauté scientifique, académique et industrielle, en France et à l’étranger. Ses équipes jouent un rôle actif dans différents réseaux européens : P4EU, EuroMAbNet et ARBRE-MOBIEU, coordonné par l’équipe Biophysique moléculaire de la plateforme.
Expertises et services
Production de protéines recombinantes :
- Optimisation des conditions de production : constructions génétiques, systèmes d'expression (microorganismes procaryotes et eucaryotes, lignées cellulaires d’insectes et de mammifères) et procédés de culture (échelle microplaques ou batterie de multi-microfermenteurs),
- Culture à grande échelle en fermenteurs (jusqu'à 20 L) et bioréacteurs à usage unique (25 L),
- Purification de protéines à échelle préparative.
Production d’anticorps simple chaîne de camélidés (nanobodies) :
- Sélection et production de nano-anticorps homodimériques simple chaîne de camélidés (VHH ou nanobodies),
- Développement de tests d'immunodiagnostic sur bandelettes,
- Conjugaison de VHH avec des fluorophores et agents de contraste.
Caractérisation biophysique de macromolécules et de leurs interactions :
- Contrôle qualité d'échantillons de protéines purifiées,
- Caractérisation hydrodynamique de la taille, forme et architecture de macromolécules biologiques et de leurs assemblages par ultracentrifugation analytique (AUC), diffusion dynamique de la lumière (DLS), diffusion statique de la lumière (SEC-LS), diffusion des rayons X aux petits angles (SAXS), viscosimétrie et diffusion de Taylor,
- Caractérisation spectroscopique du repliement, de la dynamique et de la stabilité de macromolécules par dichroïsme circulaire (CD), spectroscopie de fluorescence à l’état stationnaire ou résolue en temps, fluorescence différentielle à balayage (DSF) et spectroscopie infrarouge (FTIR),
- Caractérisation thermodynamique et cinétique des interactions moléculaires et modifications conformationnelles associées par microcalorimétrie DSC et ITC, résonance plasmonique de surface (SPR), interférométrie de biocouche (BLI) et microthermophorèse (MST).
Cristallogenèse et diffraction des rayons X :
- Cristallogenèse à haut débit : criblage robotisé des conditions de cristallisation (plus de 2 200 conditions), optimisation de la qualité des cristaux, stockage et visualisation des plaques de cristallisation, fabrication robotisée de solutions de cristallisation à façon (plus de 300 solutions mères),
- Contrôle qualité des cristaux par diffraction des rayons X et détermination de structures tridimensionnelles à l’échelle atomique : criblage des cristaux, acquisition et analyse des données de diffraction,
- Stockage et analyse de données cristallographiques.
Moyens et équipements
Production de protéines :
- Plateforme robotique EVO 200 (Tecan),
- Automate d'électrophorèse capillaire LabChip GXII (PerkinElmer),
- Station de travail AMBR15-24 (Sartorius).
Ingénierie des anticorps :
- Robot piqueur de colonies Microlab Star (Hamilton).
Biophysique moléculaire :
- Appareil de diffusion dynamique de la lumière en format microplaque DynaPro DLS Plate Reader I (Wyatt),
- Détecteur de diffusion statique de la lumière couplé à un système de chromatographie d'exclusion stérique TDA302/GPCmax (Malvern Panalytical),
- Ultracentrifugeuses analytiques ProteomeLab XL-I et OptimaAUC (Beckman Coulter),
- Analyseur de dispersion de Taylor Viscosizer TD (Malvern Panalytical).
- Spectropolarimètre de dichroïsme circulaire Aviv 215 (Avis),
- Spectrofluorimètre QuantaMaster QM4CW doté d’un système laser Strobe de détection de durée de vie de fluorescence (Photon Technology International),
- Système de mélange rapide à détection de fluorescence (stopped flow) KinetAsyst SF61-DX2 (TgK Scientific),
- Fluorimètre différentiel à balayage Prometheus NT.48 (NanoTemper).
- Appareils de microthermophorèse NT.LabelFree et NT.115 (NanoTemper),
- Microcalorimètres de titration isotherme VP-ITC et ITC200 (MicroCal-Malvern) et à balayage de température VPcapDSC (Malvern Panalytical),
- Biosenseur microfluidique à résonance plasmonique de surface Biacore T200 (Biacore, GE Healthcare),
- Appareil d'interférométrie de biocouche Octet RED384 (ForteBio),
- Spectromètre de masse UltraFlextreme (Bruker) pour le contrôle qualité.
Cristallogenèse :
- Robots de cristallogenèse en nanovolumes Cartesian Nanodispenser (Genomic Solutions), Mosquito et DragonFly (SPT Labtech),
- Robot pour la fabrication à façon de solutions de cristallisation MatrixMaker (Emerald BioSystem),
- Robot de stockage et visualisation automatique des plaques de cristallisation Rock Imager (Formulatrix).
Diffraction des rayons X :
- Générateur à anode tournant Micromax-07 (Rigaku), équipé de miroirs (Osmic Blue-2), de détecteurs Image Plate (MARresearch dtb) et de systèmes cryogéniques (Oxford Cryosystems).








Comment soumettre un projet ?
Pour soumettre un projet à Pasteur Proteopole, rendez-vous sur le site internet des quatre composantes de la plateforme : Production et purification de protéines recombinantes, Ingénierie des anticorps, Biophysique moléculaire, ou Cristallographie. Des formulaires de soumission de projets sont disponibles en ligne et téléchargeables.
Les demandes peuvent être envoyées à tout moment aux adresses de contact des composantes de Pasteur Proteopole : Production et purification de protéines recombinantes, Ingénierie des anticorps, Biophysique moléculaire, ou Cristallographie. Elles sont examinées dans des délais brefs, inférieurs à deux semaines. Dans tous les cas, une réunion est organisée, éventuellement par téléconférence, entre les demandeurs et le personnel concerné de la plateforme, afin de déterminer la faisabilité du projet, la stratégie expérimentale et les modalités de mise en oeuvre.
Exemple d'utilisation
Etude des mécanismes moléculaires de la fusion des virus enveloppés et de leur inhibition par des anticorps neutralisants
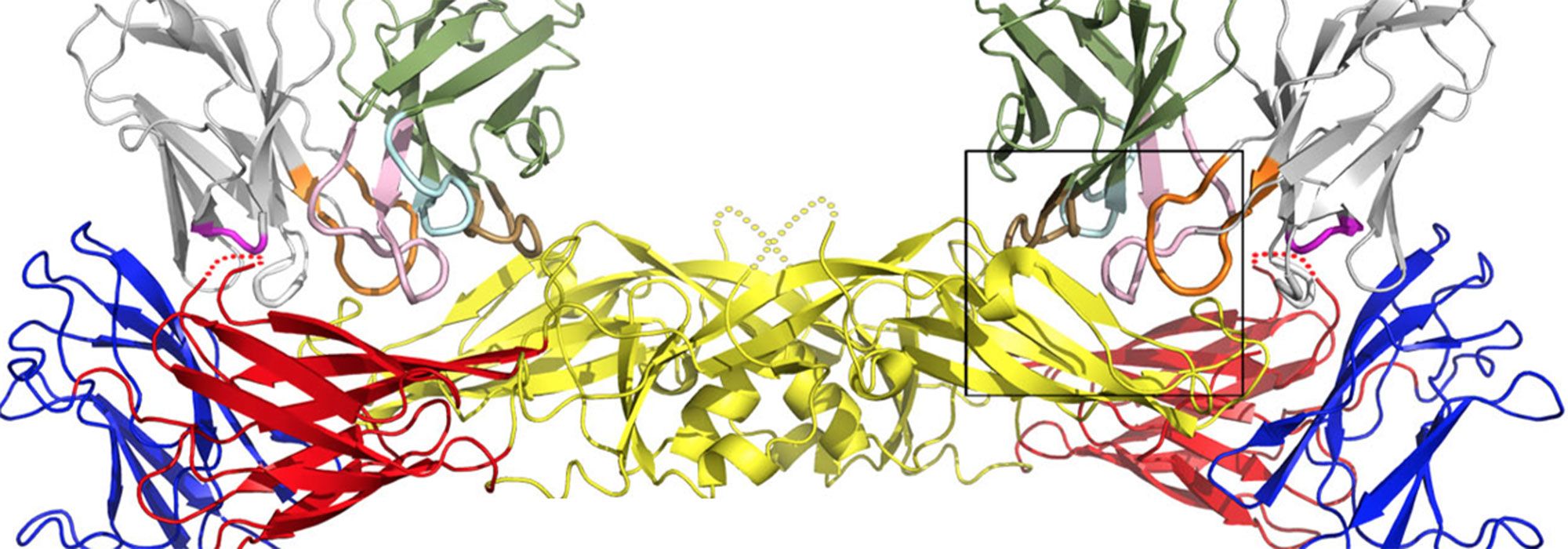
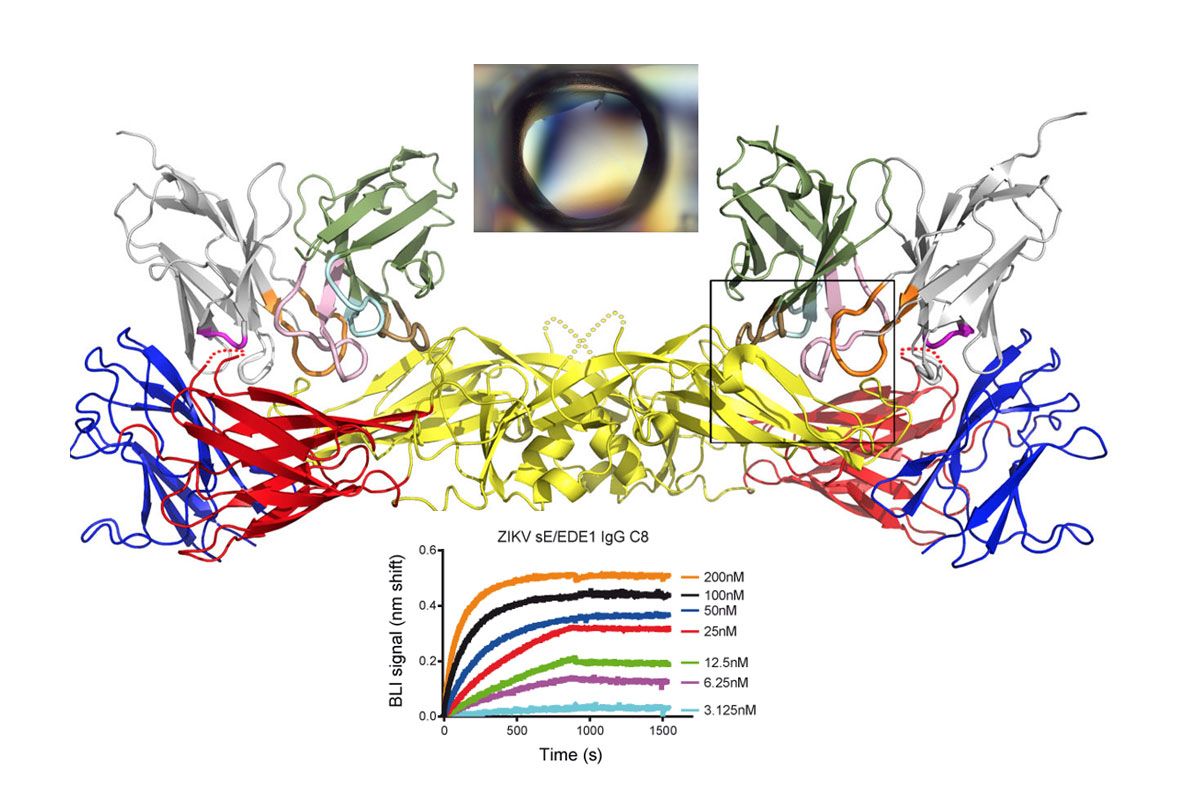
En association avec des équipes de recherche internationales, l’Unité de virologie structurale de l’Institut Pasteur collabore régulièrement et depuis de plusieurs années avec toutes les composantes de Pasteur Proteopole. Ces collaborations fructueuses (15 publications co-signées depuis 2013) ont permis de caractériser la structure et la fonction d’une grande diversité de glycoprotéines virales (zika, chikungunya, dengue, hépatite C…) et en particulier leur interaction avec les membranes lipidiques cellulaires et des anticorps neutralisants.
Pasteur Proteopole a participé en tant que partenaire majeur à toutes les étapes de ces projets, depuis la production de protéines jusqu’à leur cristallisation, en passant par l’ingénierie de nanobodies et la caractérisation biophysique des assemblages formés.
Pour en savoir plus : Barba-Spaeth G. et al. (2016). Structural basis of potent Zika-dengue virus antibody cross-neutralization. Nature, 536(7614):48-53.
Contact
Pasteur Proteopole
Institut Pasteur
28 rue du docteur Roux
75015 Paris
Région : Île-de-France patrick.england@pasteur.fr
patrick.england@pasteur.fr
Site de la plateforme
THÉMATIQUES : Biologie structurale, biophysique, biochimie
RESPONSABLES SCIENTIFIQUES :
Patrick England
RESPONSABLES TECHNIQUES :
Patrick England, Ahmed Haouz, Pierre Lafaye, Stéphane Petres, Bertrand Raynal
RESPONSABLES QUALITÉ :
Patrick Weber, Sébastien Brûlé, Sylviane Hoos
TUTELLES : CNRS, Institut Pasteur
LABELLISATION IBiSA : 2008
MOTS CLÉS : Protéines, Production et purification, Optimisation, Nanobodies, Sélection, Contrôle qualité, Hydrodynamique, Spectroscopie, Thermodynamique, Cinétique, Cristallogenèse, Cristallographie
Fiche mise à jour en 2021










