ImageUP
Expertises et technologies innovantes en microscopie et cytométrie pour l’exploration d’échantillons biologiques à différentes échelles.

ImageUP
Expertises et technologies innovantes en microscopie et cytométrie pour l’exploration d’échantillons biologiques à différentes échelles.
ImageUP
ImageUP est une plateforme technologique de service de l’Université de Poitiers, rattachée à l’UAR BioS, qui soutient la mise en œuvre de projets de recherche académique et privée principalement dans le domaine de la biologie, de la santé et de l’environnement, mais aussi des sciences de la matière. Installée sur 267 m², elle met à disposition des systèmes récents et des technologies avancées en microscopie photonique, microscopie électronique et cytométrie en flux spectrale. Ses experts accompagnent et forment les chercheurs et les doctorants à l’acquisition de données et à l’exploitation des résultats. Ils peuvent réaliser des prestations de service, participent à la formation continue des personnels et étudiants et interviennent ou organisent des actions de médiation auprès du grand public.
Expertises et services
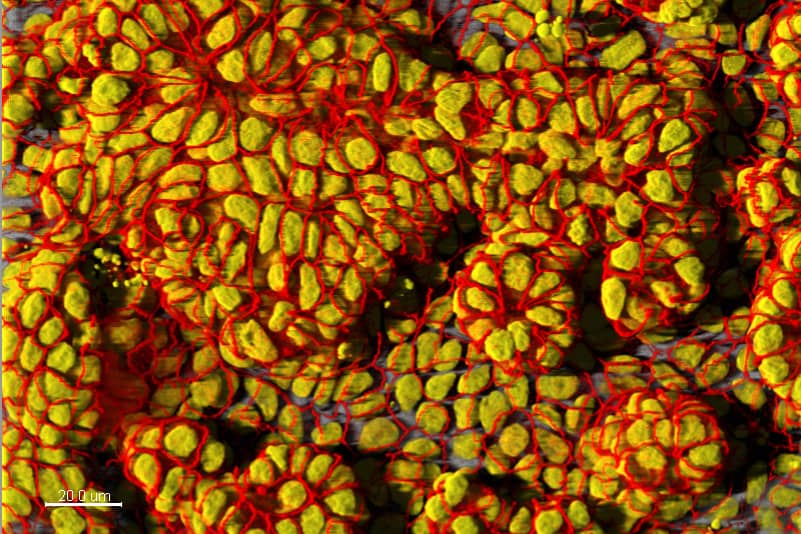
Imagerie :
- Préparation d’échantillons biologiques et acquisition d’images en microscopie photonique conventionnelle, microscopie confocale, microscopie de super-résolution STORM, microscopie 3D à feuille de lumière, techniques de FRET, FRAP, photoactivation et décageage, imagerie de phase et microscopie de conductance ionique pour l’imagerie topographique,
- Acquisition automatisée de lames virtuelles,
- Préparation d’échantillons et acquisition d’images en microcopie électronique en transmission et cryo-microscopie électronique à balayage pour l’imagerie de surface, les études 3D ultra-structurales et l’analyse chimique,
- Analyse et interprétation d’images,
- Organisation de formations théoriques et pratiques sur les équipements de microscopie et pour l’analyse d’images.
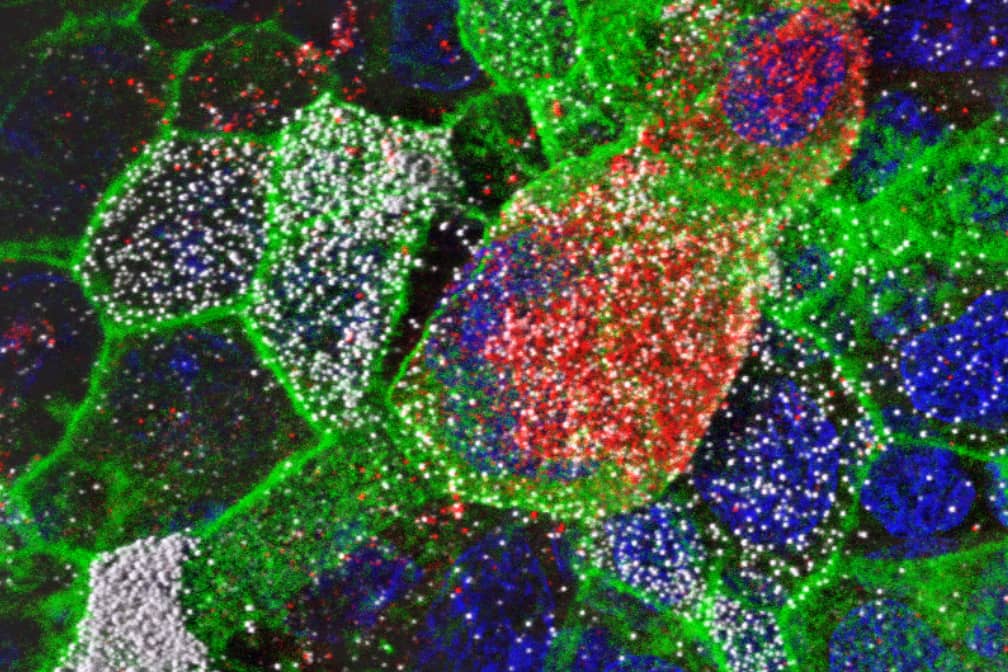
Cytométrie en flux :
- Acquisition de données de cytométrie en flux conventionnelle ou spectrale,
- Assistance pour la conception d’expériences, le choix de marqueurs, le panel design et l’analyse de données multiparamétriques,
- Tri cellulaire par cytométrie spectrale, en tubes ou en plaques.
Moyens et équipements
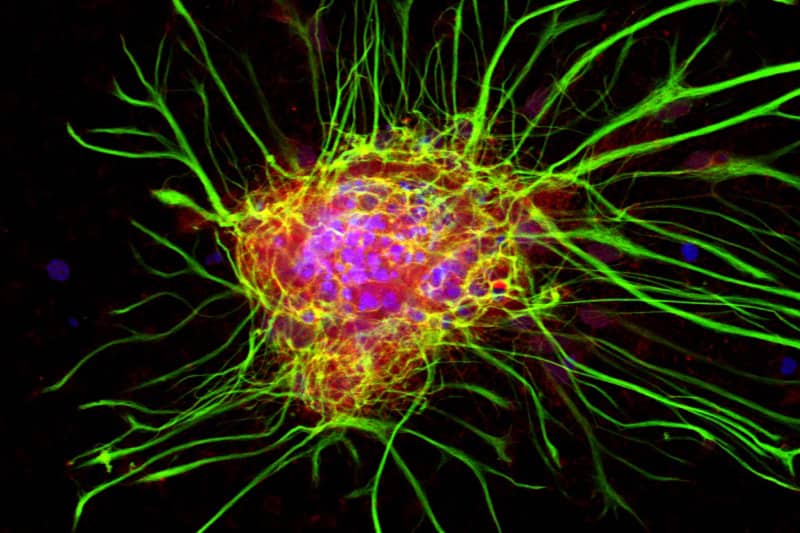
Microscopie photonique et confocale :
- Microscope à fluorescence de super-résolution STORM (Abbelight, Olympus) avec 4 lasers (405, 488, 560 et 640 nm), illumination TIRF, 2 caméras et système d’autofocus pour la détection de particules uniques,
- Microscope à feuille de lumière UltraMicroscope II (LaVision BioTec, Miltenyi) avec statifs macroscope et microscope, 4 lasers diodes (488, 561, 639 et 785 nm) et caméra refroidie Neo sCMOS (Andor) pour l’imagerie rapide 3D de grands échantillons biologiques transparisés,
- Microscope confocal à disque rotatif Revolution (Andor) avec acquisition de signaux en fluorescence et transmission au cours du temps pour l’observation de cellules vivantes nécessitant un environnement contrôlé en CO2 et température, les études de FRET, FRAP, photoactivation et décageage,
- Microscope multispectral confocal FV3000 (Evident, Olympus) pour l’observation d’échantillons fluorescents sur de grands champs,
- Microscope de conductance ionique SICM (Ionscope) pour la réalisation d’images topographiques de la surface de cellules, y compris vivantes,
- Scanner de lames VS200 (Evident, Olympus) avec caméra couleur et caméra Orca Flash 4 (Hamamatsu) pour les échantillons colorés ou fluorescents, objectifs super-apochromatiques et support de 6 lames pour l’acquisition de type « lame virtuelle » automatisée et rapide,
- Microscope de phase SID4 Element (Phasics) avec caméra Zyla5.5 (Andor) pour la génération d’images de phase de cellules vivantes,
- Macroscope MVX10 (Evident, Olympus) pour l’observation de grands champs en couleur et fluorescence,
- Logiciels ImageJ, QuPath et Imaris pour l’analyse d’images.
Microscopie électronique :
- Cryo-microscope électronique à balayage 3D Teneo VolumeScope (FEI, Fisher Biosciences) avec système blockface pour les études ultra-structurales 3D, sonde EDX pour les analyses chimiques, navette de transfert VCT500 (Leica), cryo-plonge VCM (Leica), système de sublimation et métallisation ACE600 (Leica), système de cryo-fracture,
- Microscope électronique en transmission JEM 1010 (Jeol) avec cathode de tungstène précentrée, chambre-objet avec platine goniométrique et eucentrique et caméra numérique Quemesa (Olympus),
- Ultramicrotome UC7 (Leica) pour la préparation d’échantillons,
- Logiciels Amira, MAPS et Dragonfly pour l’analyse d’images.
Cytométrie en flux :
- Analyseur spectral Aurora (Cytek) avec 5 lasers non colinéaires (355, 405, 488, 561 et 640 nm), 64 détecteurs de fluorescence et passeur de plaques automatique,
- Trieur spectral Aurora CS (Cytek) sous PSM II avec 5 lasers non colinéaires (355, 405, 488, 561 et 640 nm), 64 détecteurs de fluorescence et possibilité de tri en tubes de 1,5 à 15 mL ou en plaques de 96 ou 384 puits,
- Analyseur FACS Verse (BD Biosciences) avec 3 lasers (405, 488 et 633 nm) pour la mesure de 8 paramètres de fluorescence simultanés,
- Logiciels FlowJo, SpectroFlow et OMIQ pour l’analyse de données de cytométrie.







Comment soumettre un projet ?
Pour soumettre un projet ou accéder aux services de la plateforme ImageUP, vous pouvez adresser un mail au responsable scientifique Jean-François Jégou, ou à la responsable administrative Christelle Morillon, qui orientera votre demande. Une réunion vous sera proposée afin de vous présenter les solutions techniques adaptées et les conditions de leur mise en œuvre. Les demandes sont habituellement traitées dans un délai maximum de deux semaines.
Une fois votre projet validé, le devis correspondant accepté et les formalités administratives avancées, le personnel d’ImageUP procédera à la mise en œuvre des prestations ou à l’accompagnement de vos propres expériences. Les réservations d’équipements pourront être réalisées en ligne sur le site de la plateforme selon la disponibilité de l’ingénieur responsable du projet et dans certains cas, en toute autonomie.
Exemple de projet
Identification d’organites intracellulaires impliqués dans plusieurs maladies génétiques
La plateforme ImageUP est intervenue sur un projet visant à caractériser un nouveau mécanisme de contrôle qualité des protéines. Grâce à la microscopie électronique en transmission, les chercheurs et experts impliqués sont parvenus à mettre en évidence un nouvel organite sécréteur, le myélinosome, responsable de l'évacuation des protéines mal repliées de la cellule dans l'espace extracellulaire. Ces protéines mutantes mal repliées jouent un rôle dans la physiopathologie de maladies génétiques telles que la mucoviscidose et la maladie de Huntington.
Pour en savoir plus : Yefimova M.G. et al. (2021). Myelinosome organelles in the retina of R6/1 Huntington disease (HD) mice: Ubiquitous distribution and possible role in disease spreading. International Journal of Molecular Sciences, 22(23):12771.
Contact
ImageUP
Université de Poitiers
Pôle de biologie-santé, Bâtiment B37
1 rue Georges Bonnet, TSA 51106
86073 Poitiers
Région : Nouvelle-Aquitaine +33 (0)5 49 45 37 83
+33 (0)5 49 45 37 83
jean-francois.jegou@univ-poitiers.fr
Site de la plateforme
THÉMATIQUES : Cytométrie, Imagerie cellulaire
RESPONSABLES SCIENTIFIQUES :
Jean-François Jégou
RESPONSABLES TECHNIQUES :
Jean-François Jégou (cytométrie), Anne Cantereau-Becq (microscopie photonique et confocale), Emile Béré (microscopie électronique)
TUTELLES : CNRS, Université de Poitiers
LABELLISATION IBiSA : 2024
MOTS CLÉS : Microscopie confocale, Super-résolution, STORM, Microscopie à feuille de lumière, SICM, Spinning disk, Conductance ionique, Imagerie de cellules vivantes, Scanner de lames, Macroscopie, Microscopie électronique en transmission, Microscopie électronique à balayage, Cryo-MEB, Blockface, Sonde EDX, Cytométrie spectrale, Tri cellulaire, Analyse d’images, Analyse de données multiparamétriques
Fiche mise à jour en 2025










