Plateforme d’imagerie commune du site de Luminy (PICsl)
Microscopie optique et électronique pour l’analyse structurelle et fonctionnelle de modèles biologiques et structures subcellulaires à différentes échelles.
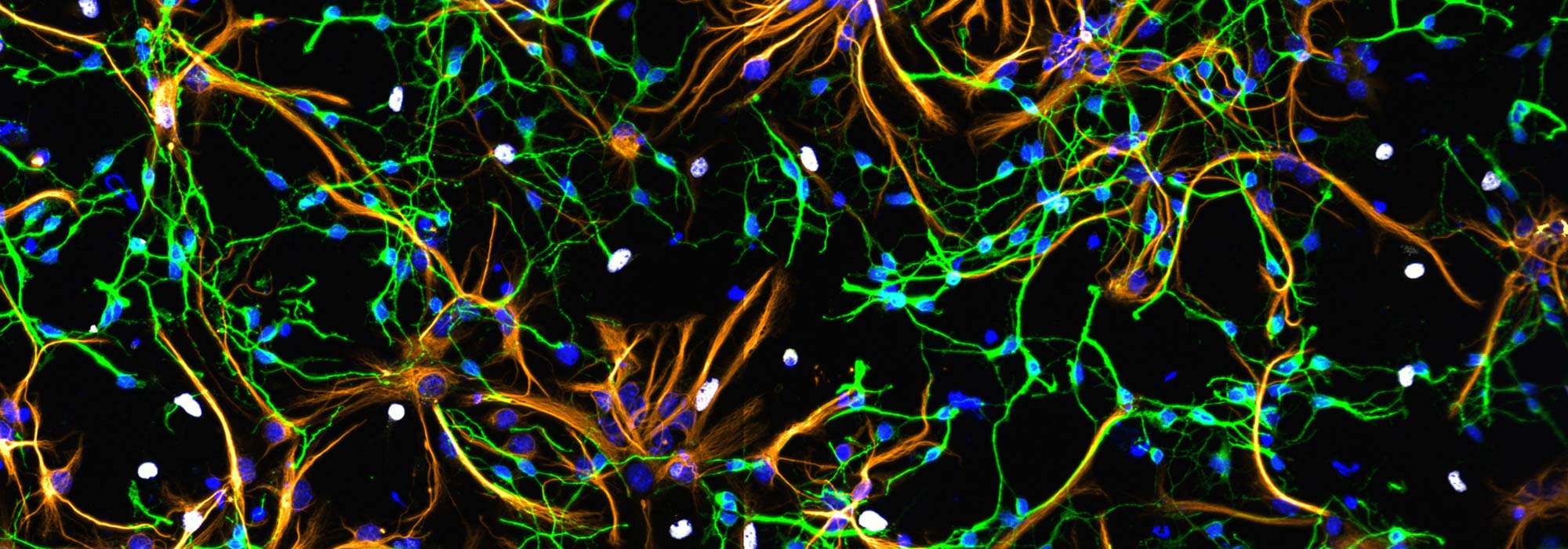
Plateforme d’imagerie commune du site de Luminy (PICsl)
Microscopie optique et électronique pour l’analyse structurelle et fonctionnelle de modèles biologiques et structures subcellulaires à différentes échelles.
Plateforme d’imagerie commune du site de Luminy (PICsl)
La plateforme PICsl de Marseille propose un large éventail d’équipements et de services en biophotonique et microscopie électronique. Elle offre ainsi à ses utilisateurs des ressources de pointe et une expertise reconnue pour l’accompagnement de leurs projets scientifiques et le développement de nouvelles approches technologiques.
Historiquement, les principaux contributeurs de la plateforme PICsl sont l’Institut de biologie du développement de Marseille-Luminy (IBDM) et le Centre d’immunologie de Marseille-Luminy (CIML). Au sein de ces instituts, plusieurs équipes de recherche conçoivent et utilisent des approches d’imagerie optique innovantes pour explorer des questions fondamentales en biologie du développement cellulaire, en biophysique et en immunologie.
Depuis 2020, PICsl intègre la plateforme de microscopie de l’Institut de microbiologie de la Méditerranée (IMM), ce qui lui a permis d'élargir son offre avec des expertises supplémentaires telles que la cryo-EM et la microscopie de super-résolution SIM. Depuis 2022, elle propose également un service de microscopie multi-échelle, rendu possible grâce à l'intégration de la plateforme de microscopie de l’Institut de neurobiologie de la Méditerranée (Inmed).
Soucieuse de garantir un haut niveau de qualité, la plateforme PICsl applique une démarche conforme au référentiel de la norme NFX 50-900. La performance et la stabilité de ses équipements sont assurées par un suivi métrologique régulier.
Expertises et services
Microscopie optique photonique :
- Microscopie utilisant les méthodes DIC, à contraste interférentiel, par réflexion et génération de seconde harmonique,
- Microscopie de fluorescence plein champ, à illumination structurée, confocale, multiphoton et spinning disk,
- Videomicroscopie avec contrôle environnemental et maintien de focus,
- Microscopie à haute résolution STED, SIM et PALM/STORM,
- Microscopie à illumination par feuillet avec transparisation et lattice lightsheet, soSPIM,
- Imagerie dynamique et F-techniques, FRAP, ratiometric-FRET et FCS,
- Microscopie corrélative en conditions cryogéniques (cryo-CLEM) ,
- Analyse d’images sous FIJI, MatLab, Imaris, Cellpose et QuPath,
- Déconvolution et reconstruction 4D avec les algorithmes Huygens,
- Stabilisation d’images par indexation sur base de données OMERO,
- ·Smart microscopy avec les applications Zeiss OAD et Nikon JOB.
Microscopie électronique :
- ·Préparation d’échantillons pour la cryo-microscopie électronique (cryo-EM) et observation de leur structure à très haute résolution,
- Préparation d’échantillons dans des conditions classiques : fixation chimique, congélation rapide sous haute pression et méthode de Tokuyasu,
- Observation de l’organisation et de la localisation de composants biologiques au microscope électronique en transmission (TEM),
- Réalisation d’images en 3D par tomographie électronique,
- Combinaison de différentes techniques d’imagerie (CLEM et cryo-CLEM) pour mieux comprendre la structure et la fonction des échantillons,
- Observation détaillée de surfaces et reconstruction 3D grâce à la microscopie électronique à balayage (SEM).
Moyens et équipements
Microscopie photonique :
- 8 microscopes confocaux : Zeiss LSM980 NIR, LSM880 Fast Airyscan et FLIM,
- 4 microscopes biphotons : Zeiss 510 NLO, Zeiss LSM880 NLO, Leica MP5 OPO et LaVision Biotec TriM Scope,
- 4 microscopes spinning disk : Roper CSU X1, spinning disk à polarisation développé par le laboratoire et spinning disk à champ large CREST,
- 6 microscopes à feuille de lumière : Zeiss Z1, soSPIM , Miltenyi Blaze, Ultra II et 2 microscopes home made,
- Microscope de super-résolution SIM Delta Vision OMX SR avec modules 3D SIM, 2D SIM, 2D SIM-TIRF et lasers 405, 488, 568 et 640 nm,
- Microscope Leica THUNDER Imager EM pour la cryo-CLEM,
- 16 videomicroscopes : 5 apotomes, 2 videomicroscopes avec contrôle environnemental, 9 microscopes et 1 vidéomicroscope à phase,
- Microscopes de haute résolution Leica 3D STED avec 2 raies de déplétion à 592 et 660 nm, option Phasor et PALM/STORM home made,
- Microscope multimodal FCS,
- Scanner de lames 3DHISTECH et scanner de plaques Zeiss CD7,
- Stations de travail dédiées au traitement d’images : Imaris (3D, tracking), QuPath, Neurolucida 360, Matlab, Huygens Decovolution, Electron Tomography, Amira, OMERO (base de données).
Microscopie électronique :
- 2 microscopes électroniques en transmission TEM FEI Tecnai 200 kV avec modules de cryo-imagerie et tomographie,
- Microscope électronique à balayage FEI Teneo VS avec système serial block face,
- Vitrobot Mark IV System,
- Serveur d'images avec 100 To dédiés à l'imagerie.

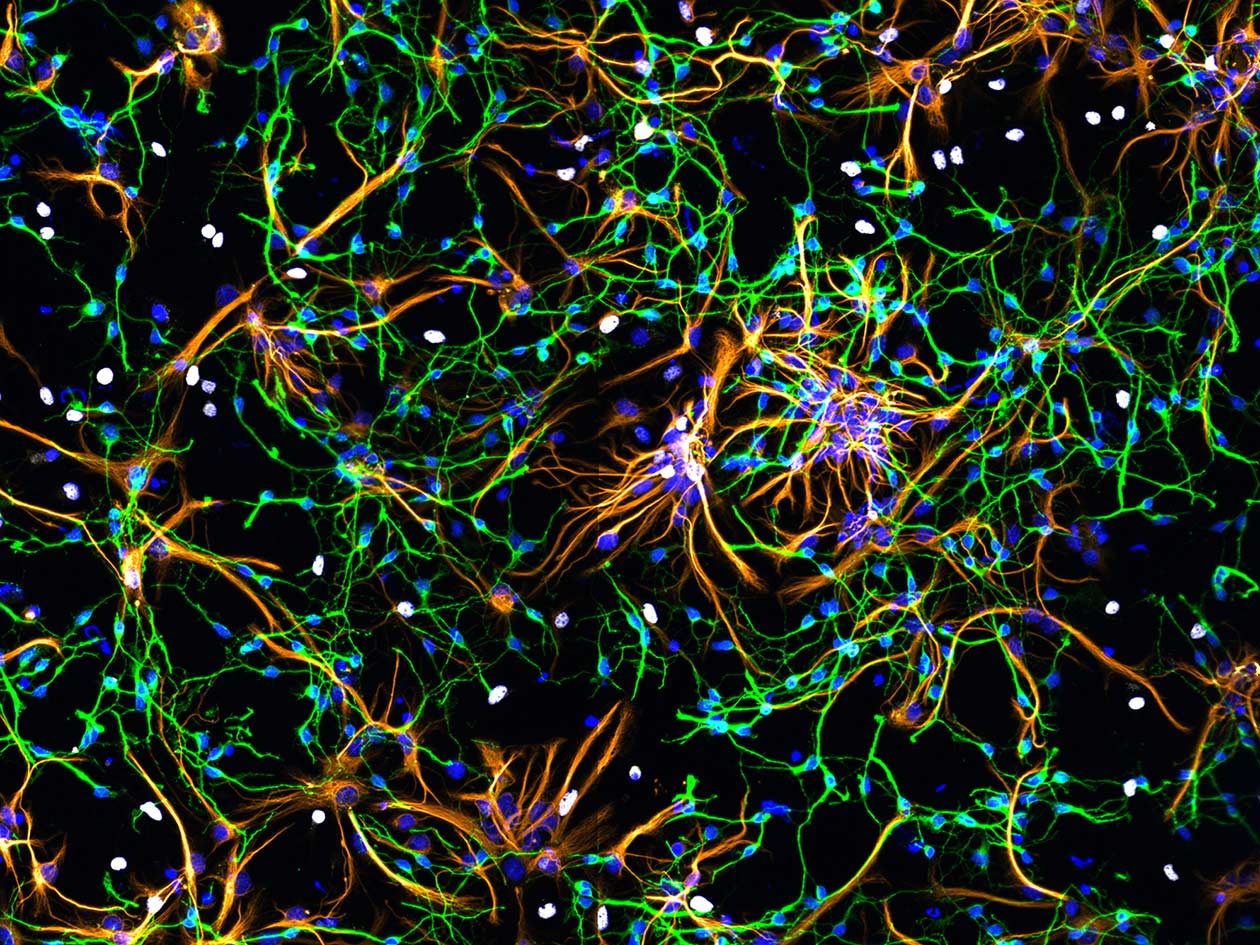
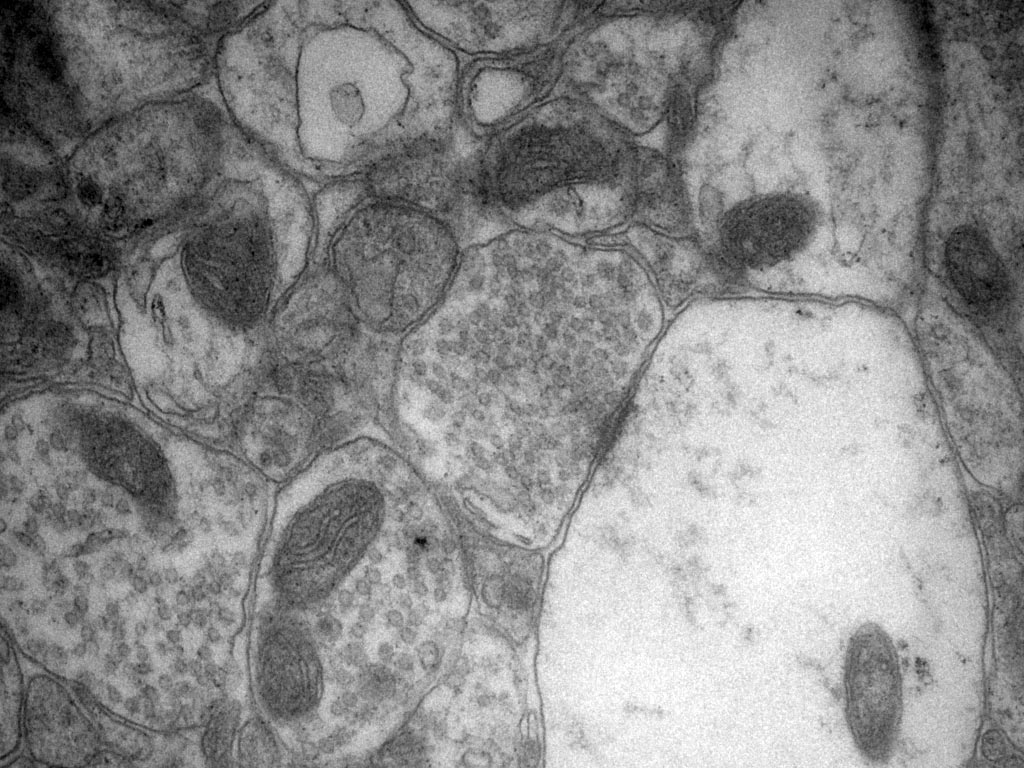

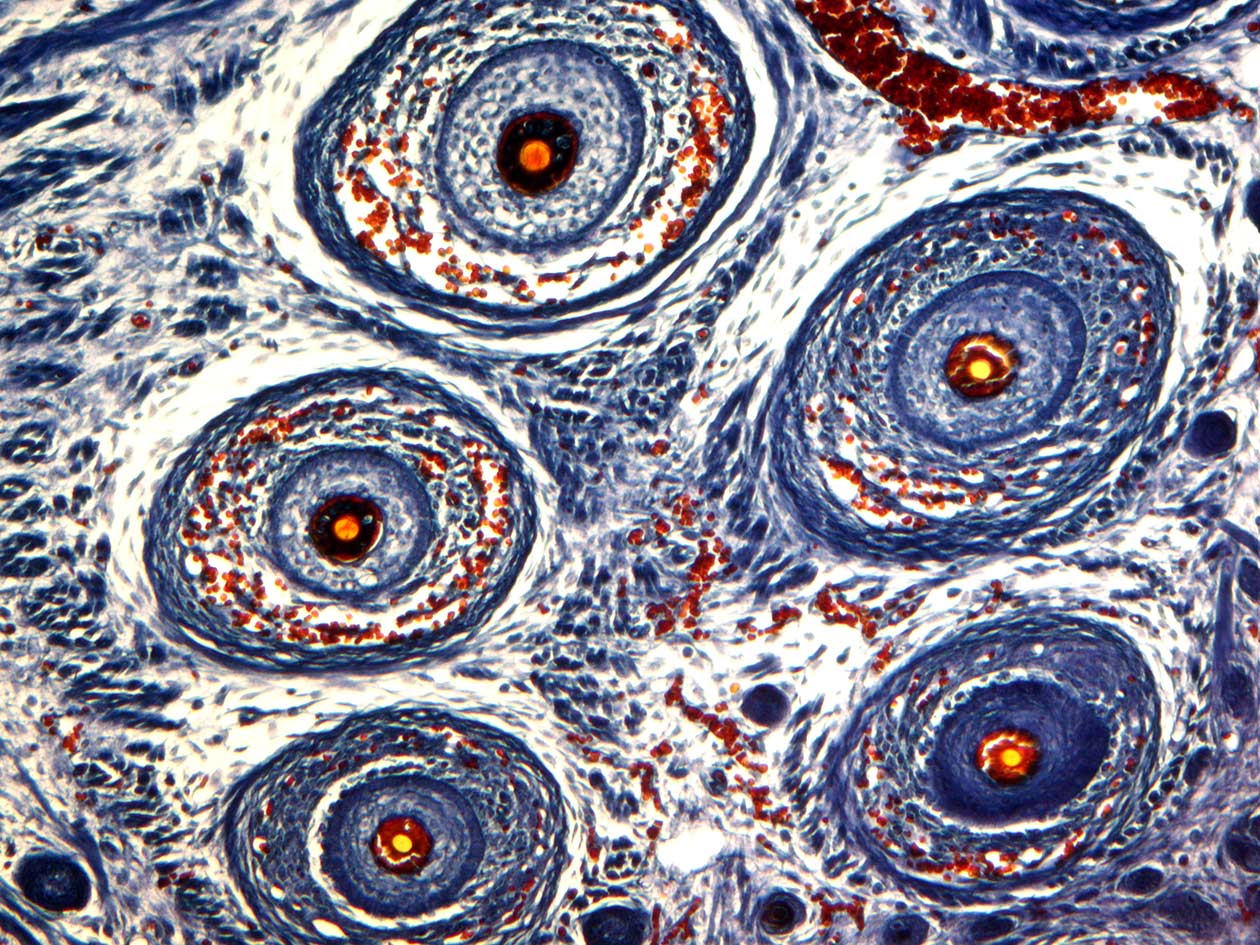

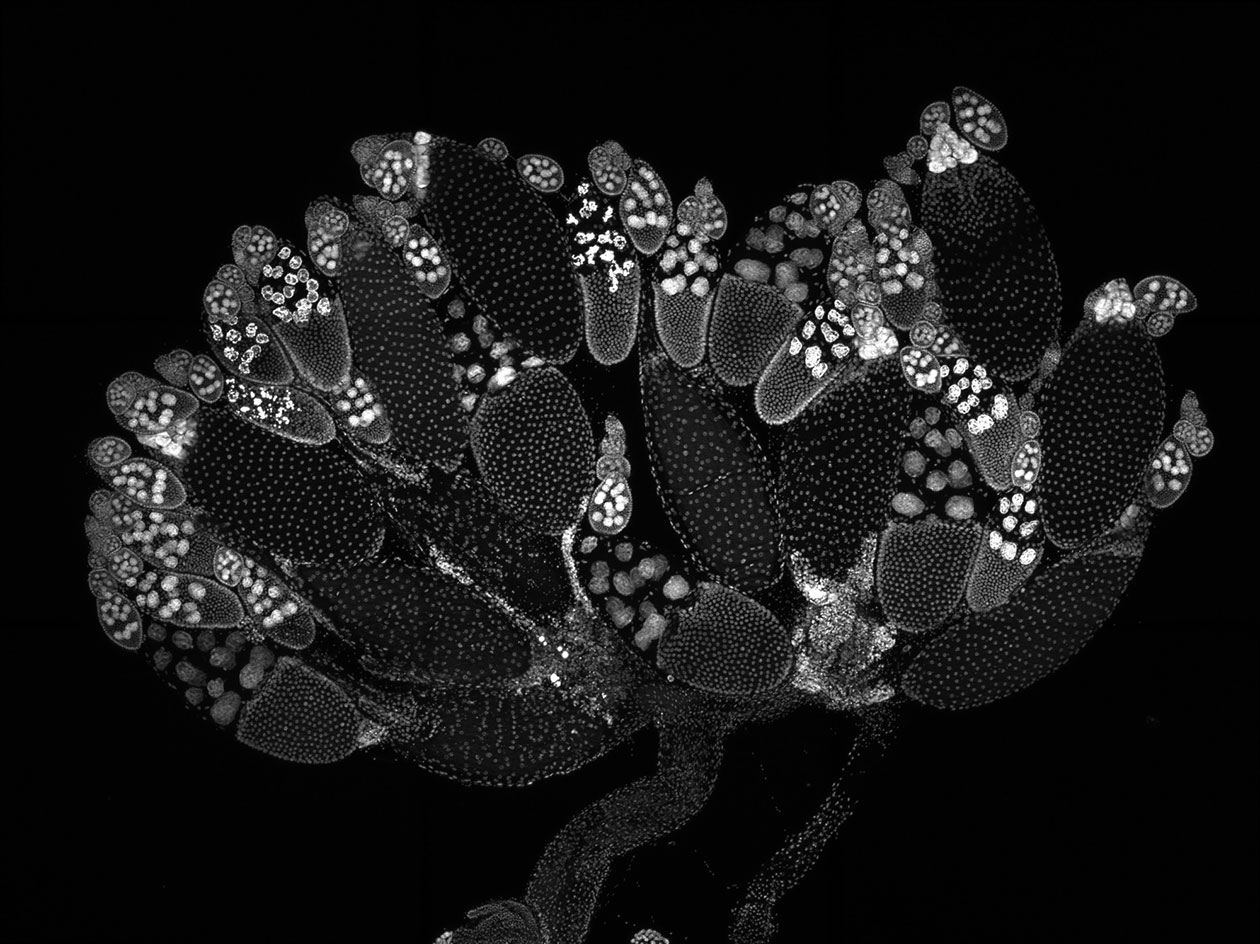
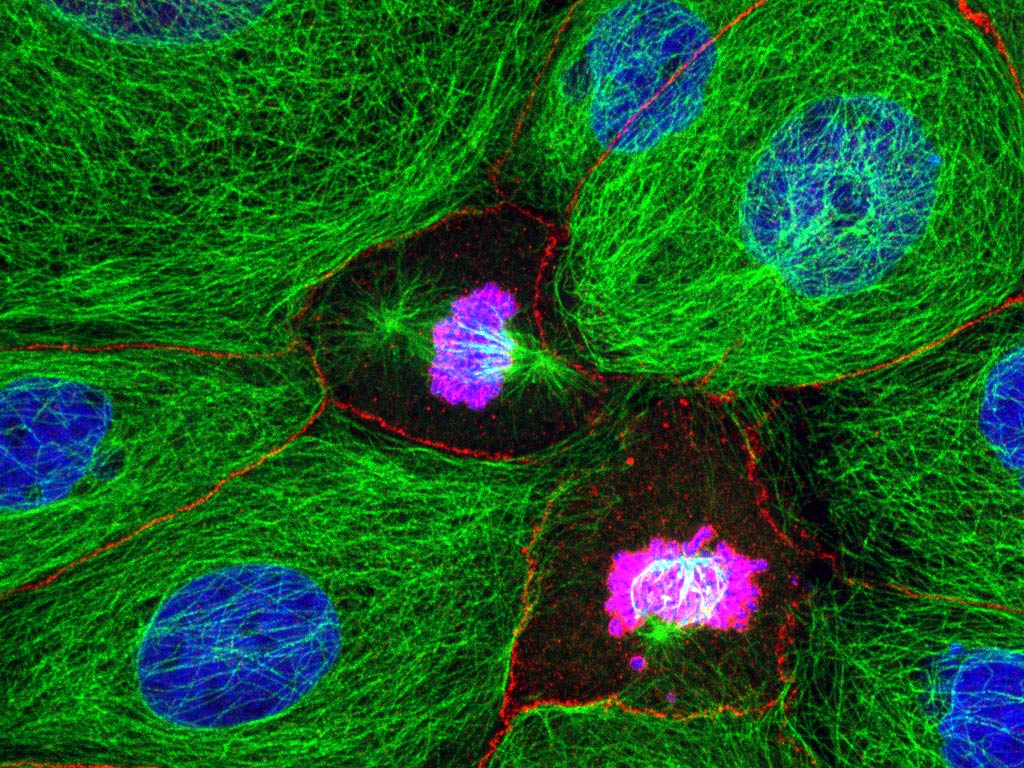

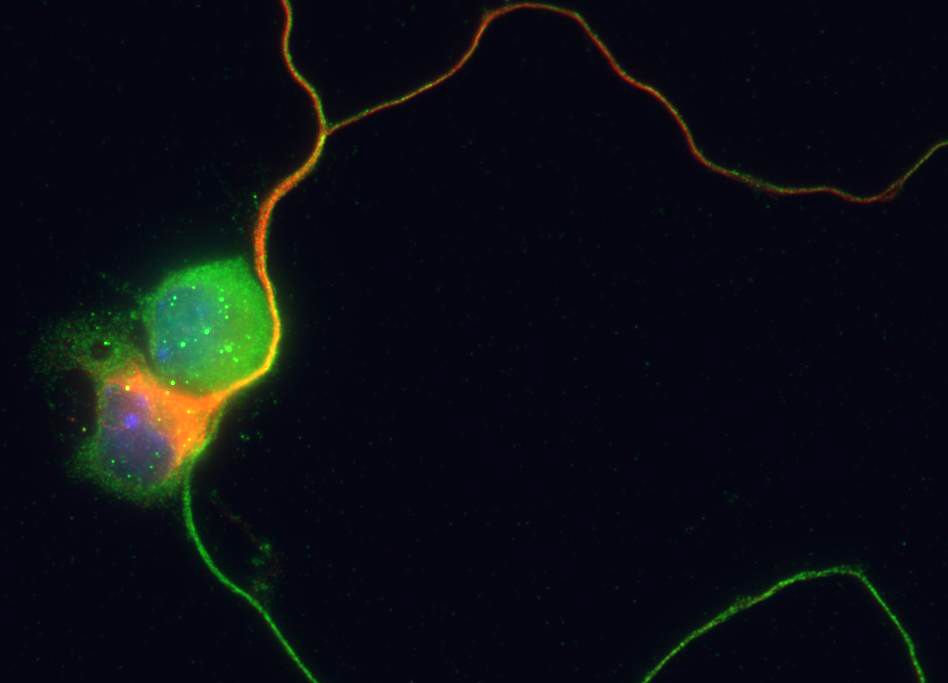
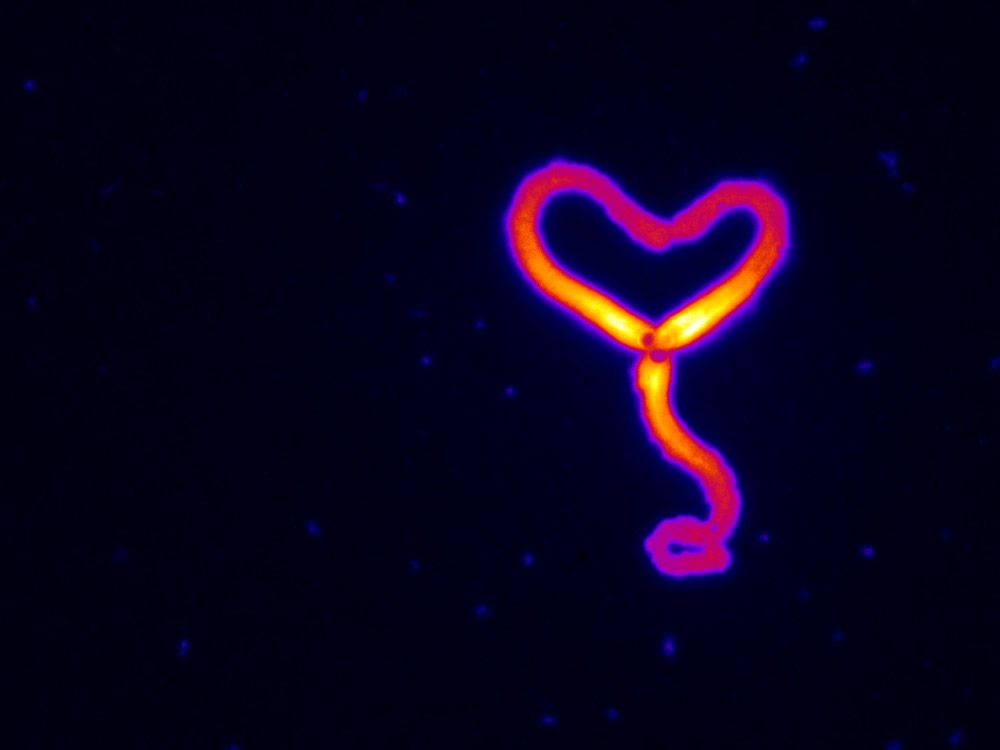


Comment soumettre un projet ?
La plateforme met à votre disposition un matériel à la pointe des avancées technologiques, vous propose un accompagnement à l’utilisation des équipements, ainsi que des formations pour optimiser vos résultats. Pour soumettre une demande à PICsl, vous pouvez prendre rendez-vous avec l’équipe de la plateforme par téléphone ou en envoyant un mail au responsable scientifique, Pierre-François Lenne. L’utilisation des instruments est facturée à l’heure. Les tarifs sont homologués par le CNRS et peuvent être intégrés dans des demandes de financement.
Contact
PICsl
IBDM, CNRS, case 907
Route de Luminy
13288 Marseille
Région : Provence-Alpes-Côte d'Azur +33 (0)4 91 26 92 57
+33 (0)4 91 26 92 57
pierre-francois.lenne@univ-amu.fr
Site de la plateforme
THÉMATIQUES : Imagerie cellulaire, Imagerie in vivo, radiobiologie
RESPONSABLES SCIENTIFIQUES :
Pierre-François Lenne
RESPONSABLES TECHNIQUES :
Cedric Matthews
RESPONSABLES QUALITÉ :
Elsa Castellani
TUTELLES : Aix-Marseille Université, CNRS, Inserm
INFRASTRUCTURES NATIONALES : France-BioImaging
LABELLISATION IBiSA : 2008
MOTS CLÉS : Haute résolution, Microscopie électronique, Imagerie 3D, Imagerie dynamique, PALM, STORM, STED, FCS, TEM, SEM, SBF, Microscopie à feuille de lumière, Smart microscopy, Formation, Traitement d’images, Machine learning, Base de données
Fiche mise à jour en 2025










