Plateforme de RMN à haut champ de Paris Saclay (RMNHC@UPSAY)
Analyse à haute résolution de la structure, de la dynamique et des interactions de macromolécules biologiques et molécules complexes d’intérêt.

Plateforme de RMN à haut champ de Paris Saclay (RMNHC@UPSAY)
Analyse à haute résolution de la structure, de la dynamique et des interactions de macromolécules biologiques et molécules complexes d’intérêt.
Plateforme de RMN à haut champ de Paris Saclay (RMNHC@UPSAY)
La plateforme RMNHC@UPSAY ouvre aux laboratoires de recherche et développement l’accès à six spectromètres de RMN équipés pour des études en liquide, avec des applications en biologie structurale et à l’interface de la chimie et de la biologie. Elle dispose également d’un système pour les études à haute pression.
Dédiée à l’analyse de la structure et de la dynamique des macromolécules biologiques, à l’étude de leurs interactions et des petites molécules complexes comme les substances naturelles, la plateforme est composée d’experts dans la production des échantillons, le développement et la mise en œuvre d’expériences de pointe, et l’analyse de données RMN.
RMNHC@UPSAY est adossée aux équipes « RMN, biologie et chimie structurales » (ICSN, Gif-sur-Yvette), « Enveloppe nucléaire, télomères et réparation de l’ADN » (I2BC, Gif-sur-Yvette) et « Structures et interactions des acides nucléiques » (LBPA, Saclay). Leurs activités de R&D permettent à la plateforme de proposer une expertise de haut niveau dans l’analyse structurale de protéines (intrinsèquement désordonnées, de haut poids moléculaire, liant les métaux, à conformations multiples...), d’acides nucléiques, de complexes biomoléculaires (protéine-protéine, protéine-ADN, protéine-ligand) et de systèmes peptidiques divers.
Expertises et services
Résonance magnétique nucléaire (RMN) :
- Conception de projets d’étude structurale par RMN adaptés aux systèmes et questions posées et accompagnement des équipes à chaque étape : attribution de résonances, étude de dynamique, détermination de structures 3D, interactions, titrages, cinétiques,
- Réalisation d’expériences de RMN multi-noyaux (1H, 2H, 13C, 15N, 19F, 31P), RMN rapide (BEST, SOFAST, ...) et RMN haute pression,
- Utilisation de méthodes d’échantillonnage non linéaire ou de projections,
- Réalisation d’expériences triple résonance 3D et 4D pour protéines et acides nucléiques,
- Réalisation d’expériences de relaxation, dispersion de relaxation, couplage dipolaire résiduel et diffusion (DOSY),
- Enregistrement de spectres RMN spécifiques des méthyls,
- Enregistrement d’expériences RMN pour la caractérisation d’interactions protéine-ligand,
- Étude de protéines fluorescentes photoconvertibles par RMN grâce à une fibre optique insérée dans le tube RMN,
- Analyse et interprétation de données avec formation des utilisateurs,
- Mise à disposition de spectromètres avec accompagnement pour utilisateurs avertis.
Production d’échantillons pour la RMN :
- Production de protéines recombinantes marquées aux isotopes (15N, 13C, 2H) en bactéries et cellules d’insectes,
- Mise à disposition de protocoles sur demande.
Moyens et équipements
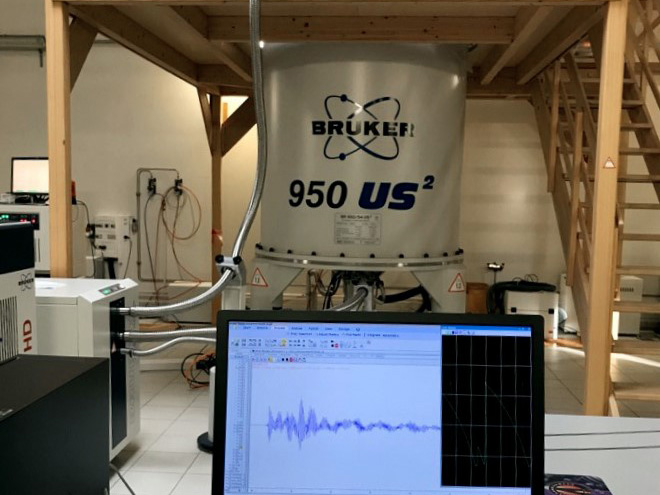
- Spectromètre 950 MHz Bruker Avance Neo (Infranalytics) équipé pour la RMN liquide d’une cryosonde TCI (1H, 13C, 15N, 2H) 5 mm et (z)-gradients travaillant de -40°C à 150°C,
- Spectromètre 800 MHz Bruker Avance III HD (IR RMN-THC) équipé pour la RMN liquide d'une cryosonde TCI (1H, 13C, 15N, 2H) 5 mm et (z)-gradients travaillant de 0°C à 80°C,
- Spectromètre 700 MHz Bruker Neo équipé pour la RMN liquide d’une cryosonde TXO (1H, 13C, 15N, 2H) optimisée pour la détection, 5 mm et (z)-gradients travaillant de -40°C à 150°C,
- Spectromètre 600 MHz Bruker Avance Neo équipé pour la RMN liquide de cryosondes TCI (1H, 13C, 15N) et QCI-F (1H, 19F, 13C, 15N) 5 mm et (z)-gradients travaillant de 0°C à 80°C, ainsi que d’un passeur d’échantillons SampleJet avec régulation de température,
- Spectromètre 600 MHz Bruker Avance III équipé pour la RMN liquide de cryosondes TXI (1H,13C,15N,2H) et TBI (1H,13C BB) 5 mm (x,y,z)-gradients et pour la RMN solide d'une sonde CPMAS (1H, 13C, 15N, 2D) 1,3 mm,
- Système à haute pression Deadalus utilisable sur tous les spectromètres RMN, avec 2 tubes en céramique de 1-2,5 kbar et 1-3 kbar,
- Système d’illumination à LED Prizmatix avec un banc portatif couplé à une fibre optique insérée dans le tube RMN.




Comment soumettre un projet ?
Pour soumettre un projet à RMNHC@UPSAY, vous pouvez envoyer un mail à l’adresse RMNHC-UPSAY@cnrs.fr. L’équipe de la plateforme vous recontactera sous deux semaines pour étudier la faisabilité de votre projet, les différentes stratégies envisageables et la nature des services qui peuvent vous être offerts. Le délai nécessaire à la réalisation des projets varie de quelques jours à plusieurs semaines selon le type d’étude et les ressources humaines disponibles sur la plateforme.
Exemple de projet
Décryptage du mécanisme d'assemblage des clusters fer-soufre chez E. coli
L’équipe de Benoit d’Autréaux à l’institut de biologie intégrative de la cellule (I2BC) a contacté la plateforme RMNHC@UPSAY afin de comprendre, étape par étape, le processus d'assemblage des clusters [2Fe-2S] par le mécanisme d'assemblage des clusters fer-soufre (ISC) de la bactérie Escherichia coli, à l'aide d'un système reconstitué in vitro et d'une combinaison de techniques biochimiques et spectroscopiques.
Les clusters fer-soufre sont des cofacteurs métalliques essentiels, synthétisés par des mécanismes multiprotéiques au travers d'un processus en plusieurs étapes dont le fonctionnement reste flou. Le mécanisme central d'assemblage bactérien comprend quatre protéines : IscU, IscS, Fdx et FdxR.
Afin de mieux caractériser le cluster fer-soufre au sein de la protéine IscU et de déterminer son état redox, les experts de la plateforme ont acquis des spectres de RMN paramagnétiques 1D 1H, qui suggèrent que les trois cystéines et l’aspartate, plutôt que l’histidine, sont les quatre ligands coordonnant le cluster [2Fe–2S] dans IscU. Ils ont également montré par RMN que le cluster [2Fe–2S] est à l'état d'oxydation 2+. La formation et la dissociation des complexes entre IscU, IscS et Fdx ont été examinées tout au long du processus d'assemblage des clusters fer-soufre par RMN 2D.
Pour en savoir plus : Gervason S. et al. (2025). The ISC machinery assembles [2Fe–2S] clusters by formation and fusion of [1Fe–1S] precursors. Nature Chemical Biology, 21(5):767-778.
doi: 10.1038/s41589-024-01818-8.
Contact
RMNHC@UPSAY
ICSN, CNRS
1 avenue de la terrasse
91190 Gif-sur-Yvette
Région : Île-de-France +33 (0)1 69 82 37 62
+33 (0)1 69 82 37 62
RMNHC-UPSAY@cnrs.fr
Site de la plateforme
THÉMATIQUES : Biologie structurale, biophysique, biochimie
RESPONSABLES SCIENTIFIQUES :
Carine van Heijenoort, Ewen Lescop
RESPONSABLES TECHNIQUES :
François Giraud, Leonardo Bartkevihi Di Piero, Nelly Morellet
TUTELLES : CEA, CNRS, ENS Paris-Saclay, Université Paris-Saclay
INFRASTRUCTURES NATIONALES : FRISBI
LABELLISATION IBiSA : 2015
MOTS CLÉS : RMN haut champ, Haute pression, Passeur d’échantillons, RMN du fluor, Biologie structurale, Protéines, Acides nucléiques, Dynamique des macromolécules biologiques, Structure, Interactions, IDP, RMN in cell, Phosphorylation, Cibles thérapeutiques, Substances naturelles
Fiche mise à jour en 2025









