BioStruct@UPSAY
Expertises et services dans le domaine de la cristallisation à haut débit, de la cryo-microscopie électronique, des interactions protéiques et des interactants artificiels.
BioStruct@UPSAY
Expertises et services dans le domaine de la cristallisation à haut débit, de la cryo-microscopie électronique, des interactions protéiques et des interactants artificiels.
BioStruct@UPSAY
Localisée sur le campus Paris-Saclay, la plateforme BioStruct@UPSAY regroupe quatre plateformes spécialisées dédiées à la cryo-microscopie électronique (cryo-EM), à la cristallisation à haut débit, aux interactions protéiques et à aux interactants artificiels (alphaReps).
La plateforme de cryo-EM était à l'origine hébergée au laboratoire Virologie moléculaire et structurale (VMS). Les groupes internes associés fournissent une assistance scientifique et technique de haut niveau, ainsi que des contributions et révisions pour les travaux réalisés sur l'installation de microscopie électronique. Ils constituent une force notable dans ce domaine.
La plateforme de cristallisation à haut débit est issue de la fusion de deux autres plateformes installées à l'Institut de biochimie et biophysique moléculaire et cellulaire (IBBMC) d’Orsay et au Laboratoire d'enzymologie et biochimie structurales (LEBS) de Gif-sur-Yvette. Elle est équipée d'un grand nombre de robots de pipetage et de visualisation.
La plateforme d’interactions de macromolécules (PIM) est également issue de la fusion de l’IBBMC et du LEBS. Elle est équipée d'un ensemble d'instruments très complémentaires dédiés à la biophysique des interactions protéiques et à la caractérisation des protéines.
Enfin, la plateforme alphaReps, récemment créée, se consacre à la conception de ligands protéiques artificiels de haute affinité dirigés contre des protéines cibles. Les quatre plateformes associées au sein de BioStruct@UPSAY travaillent de manière indépendante ou en synergie selon les projets qui lui sont confiés.
Expertises et services
- Observation d'échantillons biologiques par microscopie électronique après coloration négative : protéines, complexes multiprotéiques, virus, liposomes et assemblages multimoléculaires,
- Vitrification d'échantillons,
- Enregistrement d'images de cryo-microscopie électronique et détermination de structures 3D,
- Observation de complexes in situ : protéines à la surface d'organites purifiés, glycoprotéines de virus enveloppés, protéines membranaires reconstituées dans des liposomes et autres,
- Conseil pour l'analyse d'images 3D,
- Criblage de cristallisation assisté par robots de pipetage,
- Visualisation automatisée des essais de cristallisation à 20°C et 4°C,
- Détermination de structures cristallines,
- Mesure d'interactions protéiques par des méthodes en solution, avec un partenaire lié à une surface ou des sondes de fluorescence,
- Caractérisation des constantes d'affinité (Kd), des propriétés thermodynamiques et cinétiques, et de la stoechiométrie,
- Caractérisation des propriétés des macromolécules : stabilité, état d'oligomérisation et agrégation,
- Sélection par phage display et utilisation de ligands artificiels (alphaReps) pour faciliter la cristallisation de cibles difficiles.
Moyens et équipements
Cryo-microscopie électronique :
- Microscope électronique Glacios 2 200 kV FEG (TFS) avec camera Falcon 4i (à partir de 2024),
- Microscope électronique Tecnai Spirit 120 kV LaB6 (FEI) avec camera K2 Base,
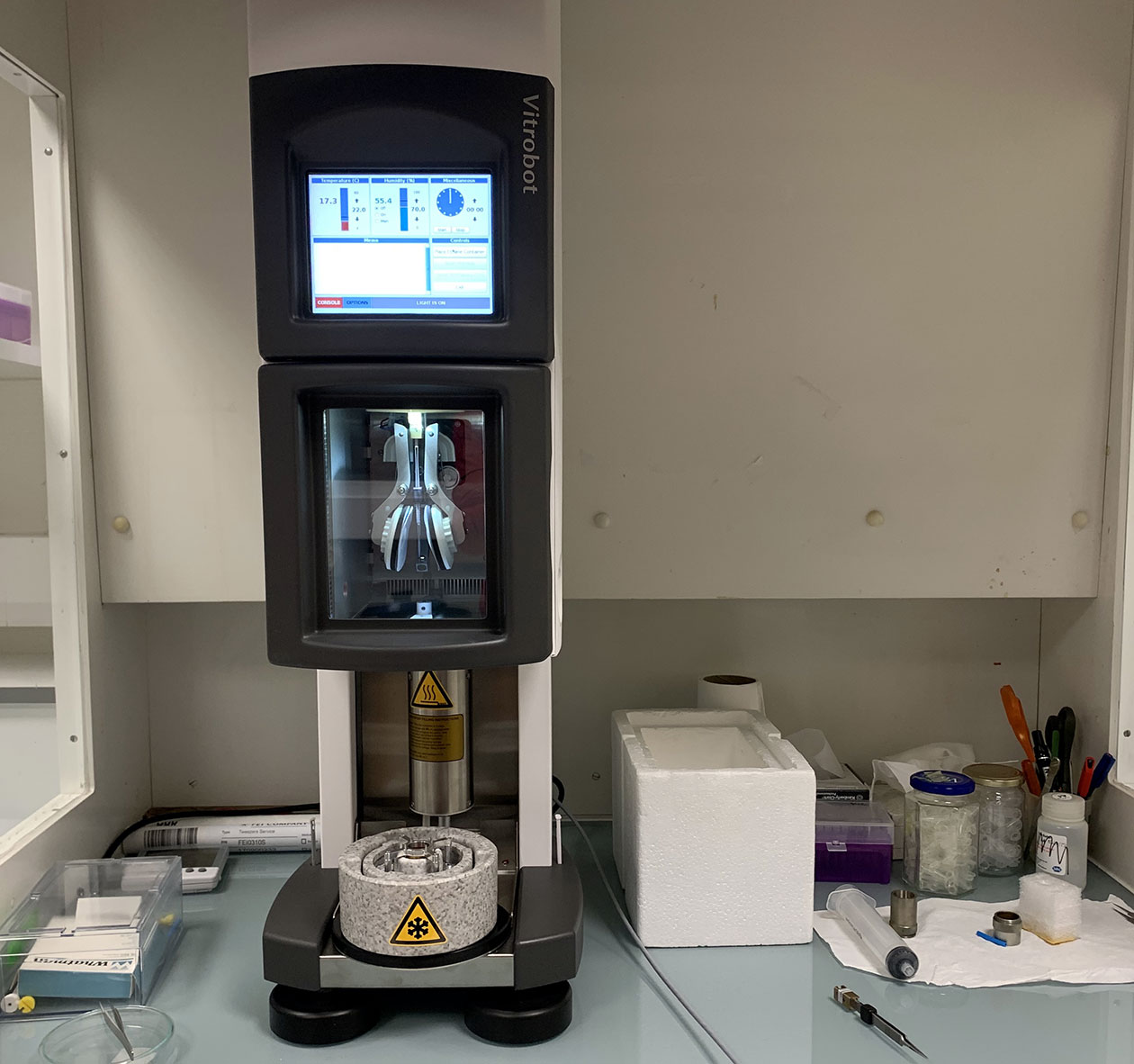
- Vitrobot Mark IV (FEI),
- Plunge Freezer (Leica).
Cristallisation :
- 2 robots de cristallisation Cartesian Microsys et Mosquito LCP (SPT Labtech),
- 2 robots de visualisation Rock Imager 182 et 1000 (Formulatrix).
Analyse de la stabilité des complexes et caractérisation biophysique :
- Calorimètre à balayage MicroCal PEAQ-DSC (Malvern),
- Ultracentrifugeuse analytique Optima XL-I et détecteur de fluorescence (Beckman Coulter),
- Omnisec Resolve-Reveal (Malvern),
- Tycho (NanoTemper) et TSA/DSF (Applied Biosystem).
Analyse des interactions biologiques :
- 2 calorimètres isothermes MicroCal PEAQ-ITC et ITC200 (Malvern),
- Biolayer interféromètre Octet RED96e (Sartorius),
- HeliX Biosensor (Dynamic Biosensor),
- MST Monolith NT.115 (NanoTemper).
Sélection de protéines artificielle de grande affinité :
- Banque de 1,7 x 109 variants de protéines artificielles (alphaReps) au format phage display.
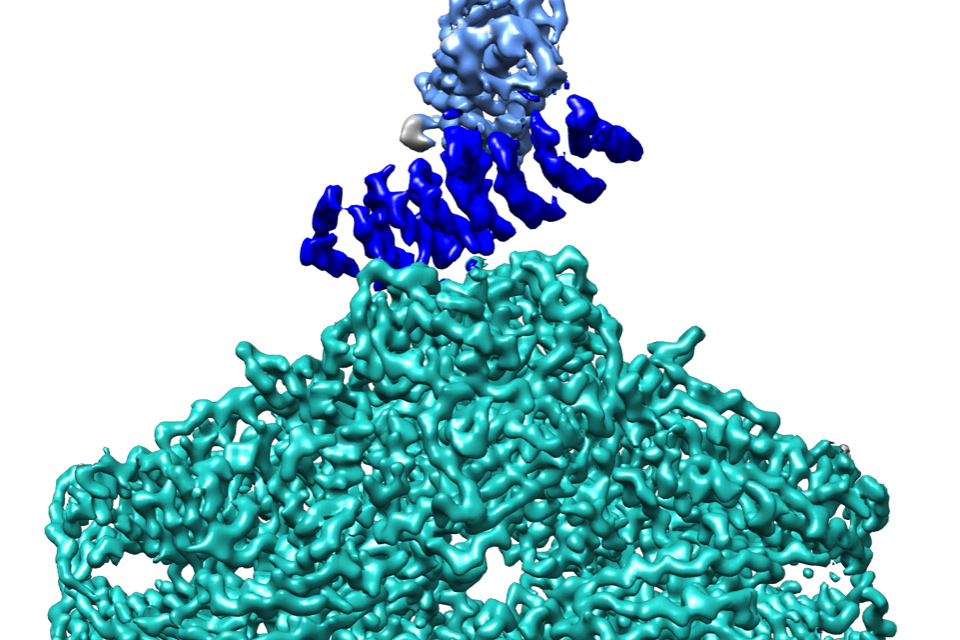
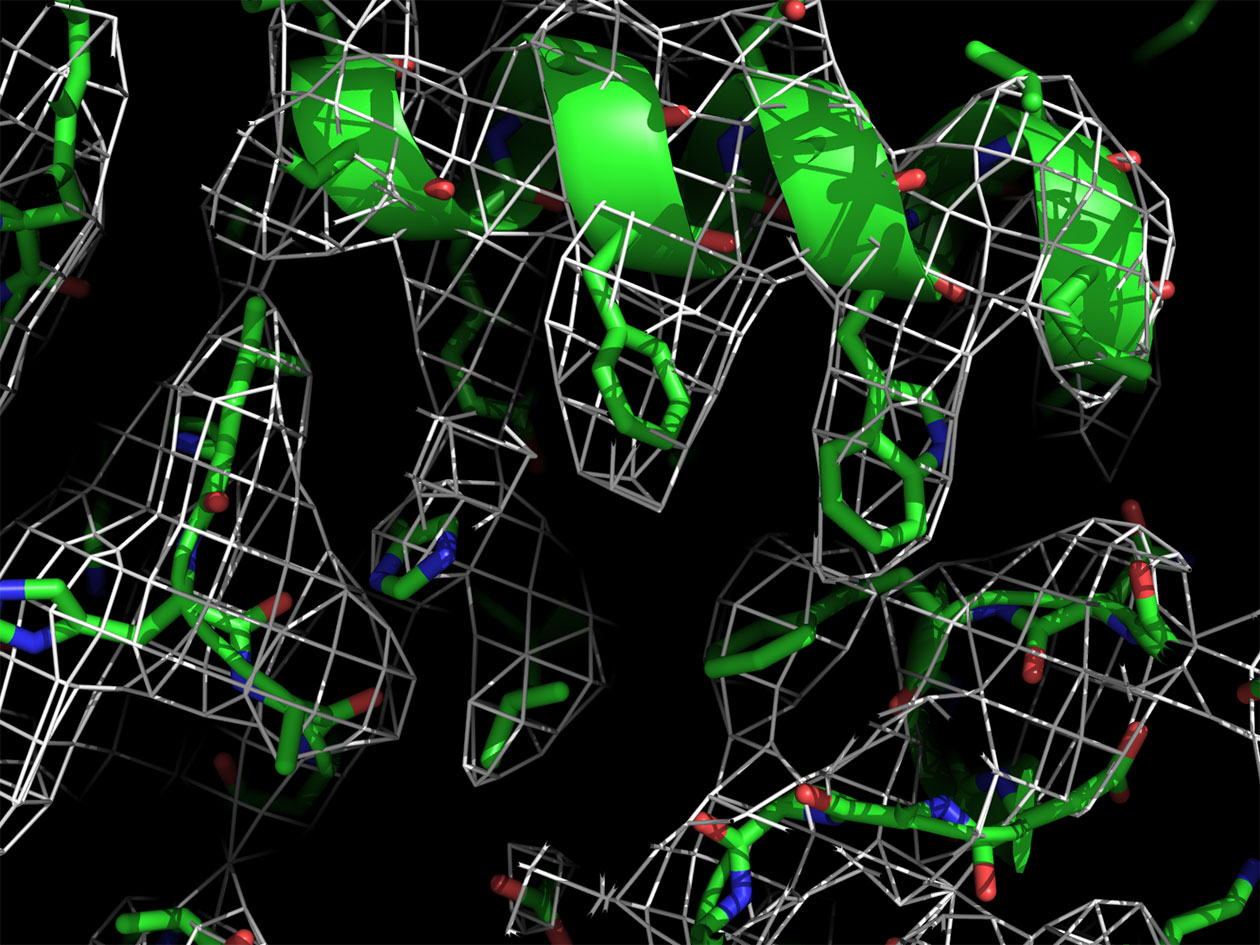

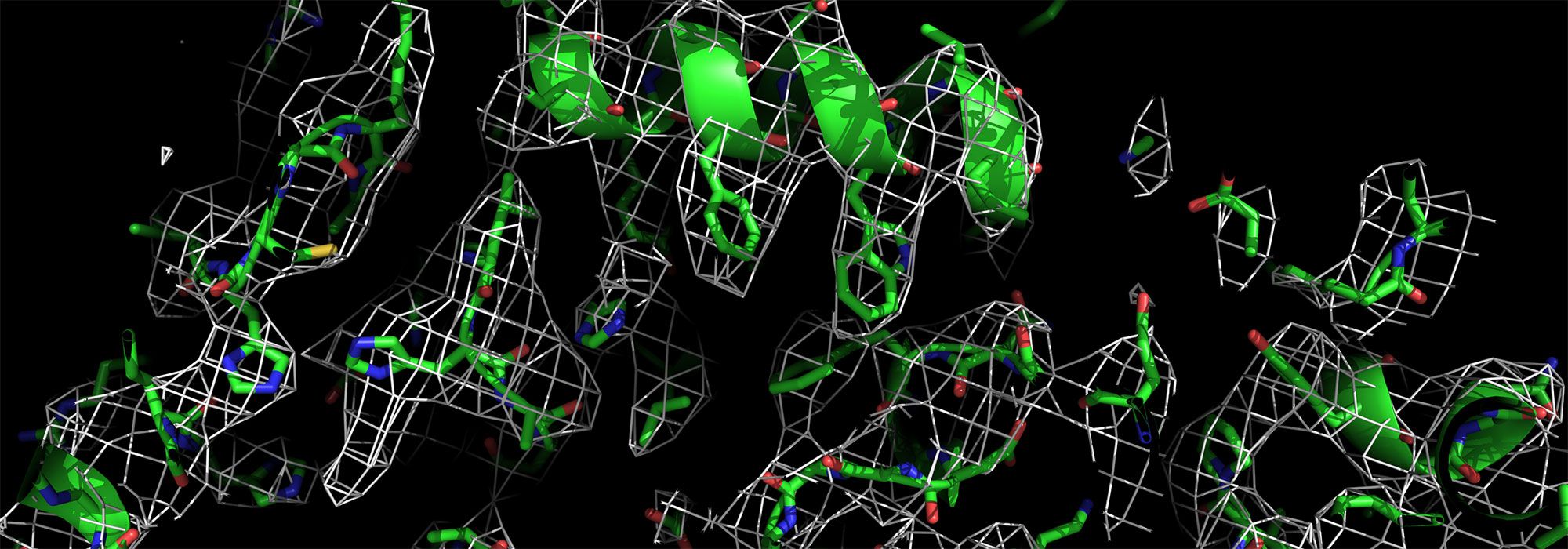
Comment soumettre un projet ?
Vous pouvez contacter l’interlocuteur de votre choix à partir des coordonnées disponibles sur le site web de la plateforme BioStruct@UPSAY. Une réunion sera organisée pour discuter du projet, évaluer sa faisabilité et les délais avec les ingénieurs spécialistes de la technique envisagée. Une attention particulière sera demandée concernant la qualité des échantillons fournis (pureté, homogénéité et stabilité).
Exemple de projet
Visualisation d’un assemblage protéique par cryo-EM et reconstruction 3D
A l’Institut de biologie intégrative de la cellule (I2BC), l'équipe « Modélisation et ingénierie des protéines » utilise la biologie combinatoire et l'évolution dirigée pour générer des protéines artificielles à motifs répétés, les alphaReps, qui peuvent lier spécifiquement des protéines cibles choisies. Les chercheurs ont ainsi entrepris l'ingénierie d'assemblages moléculaires utilisant des alphaReps. Ils ont récemment tenté de mettre au point un système générique permettant de lier toute structure cible à une structure porteuse afin d’imager la cible par cryo-microscopie électronique (cryo-EM). Ils se sont pour cela associés à la plateforme de cryo-EM de BioStruct@UPSAY.
La protéine fluorescente verte (GFP) a été choisie en tant que cible pour la preuve de concept. Plusieurs constructions ont été mises en oeuvre à partir d'une alphaRep liant la GFP. Cette alphaRep a été fusionnée, soit directement à une structure porteuse, soit à une autre alphaRep liant la structure porteuse (double alphaRep tête-bêche). Les protéines ainsi conçues ont été produites et imagées. Des jeux de données de cryo-EM ont été collectés et analysés pour 6 de ces assemblages. Une preuve de concept du potentiel de la stratégie a été apportée pour un assemblage utilisant comme structure porteuse la béta-galactosidase d'E. coli, un tétramère de symétrie D2 de 520 kDa. La reconstruction 3D a mis en évidence la double αRep tête-bêche liant d'un côté la béta-galactosidase et de l'autre la GFP. Le site d'interaction avec la béta-galactosidase se situe sur un axe de symétrie du tétramère.
Ce premier succès montre les perspectives que la démocratisation de la cryo-EM peut offrir à l'ingénierie des protéines, en permettant de visualiser rapidement et jusqu'à l'échelle atomique des assemblages conçus rationnellement ou par évolution dirigée.
Contact
BioStruct@UPSAY
Institut de biologie intégrative de la cellule (I2BC)
1 avenue de la Terrasse
91198 Gif-sur-Yvette
Région : Île-de-France +33 (0)1 69 82 61 16
+33 (0)1 69 82 61 16
stephane.bressanelli@i2bc.paris-saclay.fr
Site de la plateforme
THÉMATIQUES : Biologie structurale, biophysique, biochimie
RESPONSABLES SCIENTIFIQUES :
Stéphane Bressanelli, Herman van Tilbeurgh, Stéphanie Marsin, Agathe Urvoas
RESPONSABLES TECHNIQUES :
Ana Andreea Arteni, Inès Li de la Sierra-Gallay, Armelle Vigouroux, Magali Noiray
TUTELLES : CEA, CNRS, Université Paris-Saclay
INFRASTRUCTURES NATIONALES : FRISBI
LABELLISATION IBiSA : 2009
MOTS CLÉS : Biologie structurale, Cryo-microscopie électronique, Tomographie, Cristallogénèse, Complexes protéiques, Interaction protéine-protéine, Interaction protéine-acides nucléiques, Calorimétrie, Thermodynamique, alphaReps, Constantes d’affinité
Fiche mise à jour en 2023









