ImagoSeine
Cytométrie en flux, microscopie électronique et photonique pour la visualisation et l’analyse de la structure, de la dynamique, des interactions et des fonctions dans les échantillons biologiques.
ImagoSeine
Cytométrie en flux, microscopie électronique et photonique pour la visualisation et l’analyse de la structure, de la dynamique, des interactions et des fonctions dans les échantillons biologiques.
ImagoSeine
ImagoSeine est la plateforme de service, de recherche et développement de l'Institut Jacques Monod. Ouverte à l'ensemble de la communauté scientifique, nationale et internationale, publique et privée, elle réunit en un même lieu des expertises et des équipements de cytométrie en flux, microscopie électronique et photonique.
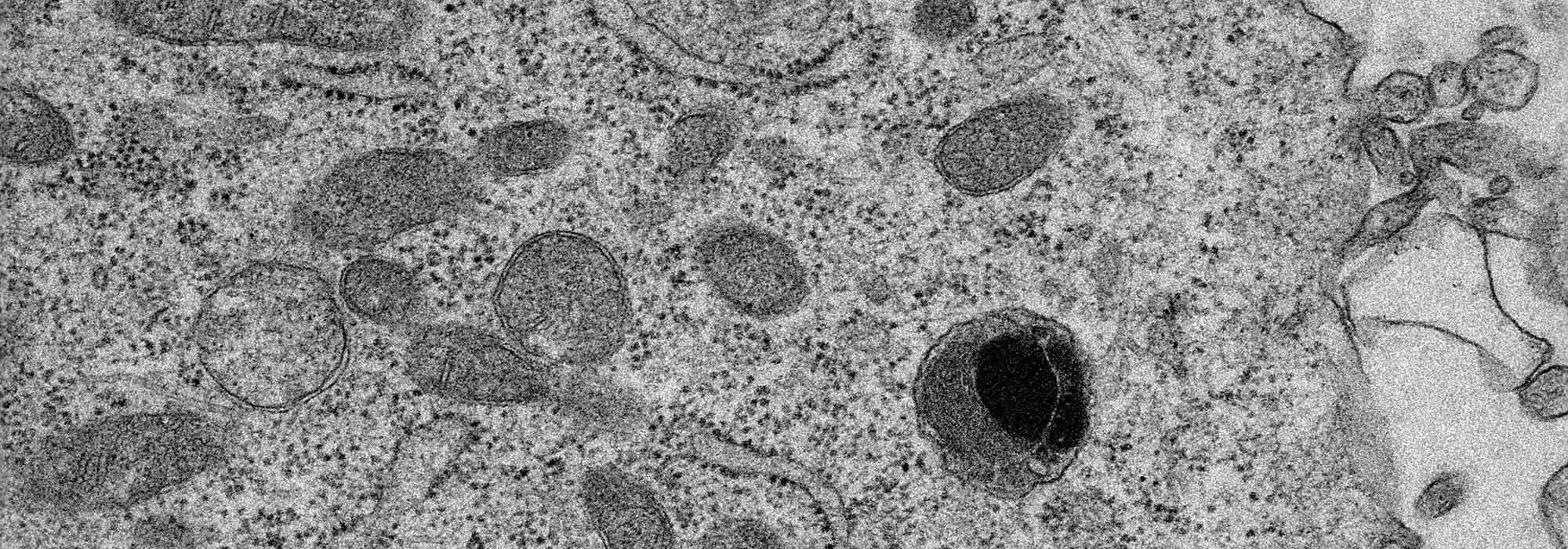
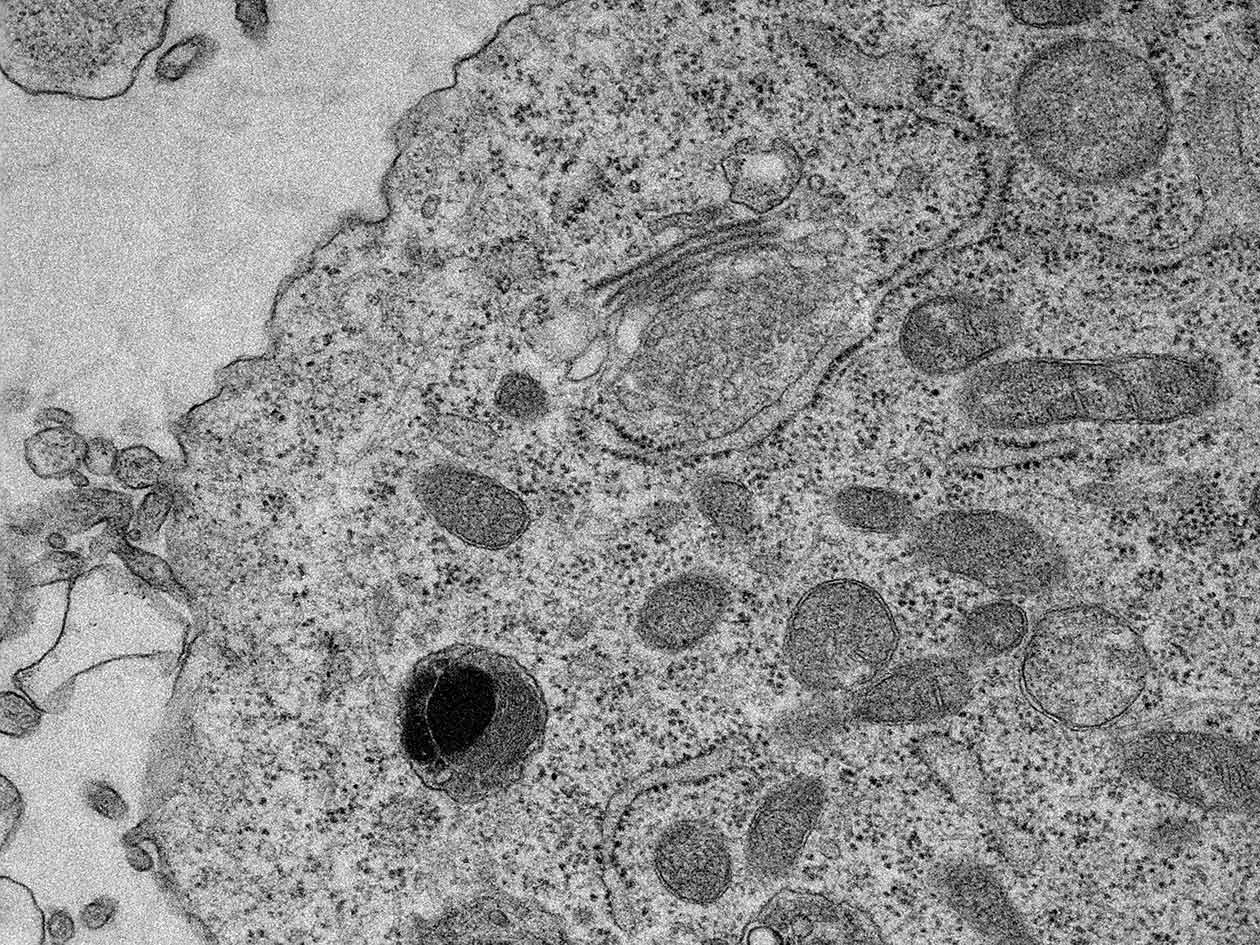
La cytométrie en flux permet l’analyse qualitative et quantitative multiparamétrique et multi-couleurs, ainsi que le tri de cellules à haut débit, en fonction de la taille, la granulosité et l'intensité de fluorescence d’éléments en suspension. La microscopie électronique rend accessible l'analyse ultrastructurale de la cellule et de ses composants. Elle comprend la microscopie à transmission, la microscopie à balayage de type serial block-face et la préparation des échantillons à température ambiante ou basse température. La microscopie photonique offre la possibilité de visualiser et d’analyser les structures et les processus dynamiques au niveau cellulaire (procaryotes et eucaryotes) et tissulaire. Elle permet des observations de la molécule unique à l’organisme entier.
Expertises et services
- Mise à disposition des équipements de la plateforme, aide au choix des équipements les mieux adaptés à un projet et formation à leur utilisation,
- Développement de protocoles sur mesure,
- Préparation des échantillons,
- Tri cellulaire et analyse,
- Acquisition d’images et réalisation de reconstructions tridimensionnelles en microscopie photonique et microscopie électronique,
- Formation aux logiciels de traitement et d’analyse d’images.
Moyens et équipements
Cytométrie en flux :
- Trieur FACS Aria Fusion BD Biosciences,
- Analyseur Attune CytPix Invitrogen,
- Logiciel de traitement de données FlowJo.
Microscopie électronique :
- Microscope électronique à transmission 12-BT Tecnai, 80-120 kV, Filament LaB6, avec porte objet tomographie et caméra OneView 4k Gatan avec logiciel GMS3,
- Microscope électronique à balayage Teneo VS TFS (serial block-face imaging),
- Cryo-microscope électronique à transmission Glacios, 200 kV TFS, caméra Falcon 4i et Ceta 16M (tomographie à température ambiante),
- Appareil de congélation haute pression EM-PACT2-RTS Leica,
- Automate de cryo-substitution AFS2 équipé du FSP Leica,
- Cryo-ultramicrotome UC7-FC7 Leica,
- Ultramicrotomes UC6 et UCT Leica,
- Automate d’immunomarquage IGL Leica.
Microscopie photonique :
- Microscopes plein champs à épifluorescence DMI6000 Leica et Axio Observer Z.1 Zeiss,
- Stéréomicroscope Lumar Zeiss,
- Microscopes confocaux LSM780 Zeiss et LSM980 Zeiss avec Airyscan 2,
- Microscopes spinning disc CSU-W1 Nikon, CSU-X1 Gataca et CSU-X1 Zeiss,
- Microscope de super-résolution Elyra 7 avec Lattice SIM, dSTORM et PALM,
- Modules FLIM-FRET-FCS MicroTime PicoQuant, FRAP, ablation laser UV et 2 photons,
- Microscopes tous équipés d’une chambre thermostatée et d’un contrôleur de CO2 pour maintenir les échantillons en vie,
- 2 stations d’analyse avec logiciels Imaris, Amira, ZEN, MetaMorph, MatLab, FIJI et ICY.
Culture cellulaire :
- Laboratoire de niveau L2,
- Incubateur, centrifugeuse et PSM.










Comment soumettre un projet ?
Prenez contact avec la plateforme en envoyant un mail à l’adresse imagoseine@ijm.fr. Un rendez-vous sera fixé pour discuter de votre projet. Après avoir rempli une fiche individuelle et une demande de projet, documents accessibles sur le site de la plateforme, vous serez orienté vers l’équipement le mieux adapté. Les prestations pourront être exécutées en toute autonomie après formation, ou avec l’assistance d’ImagoSeine. Vous pourrez réserver les équipements en ligne, directement sur le site de la plateforme.
Exemple de projet
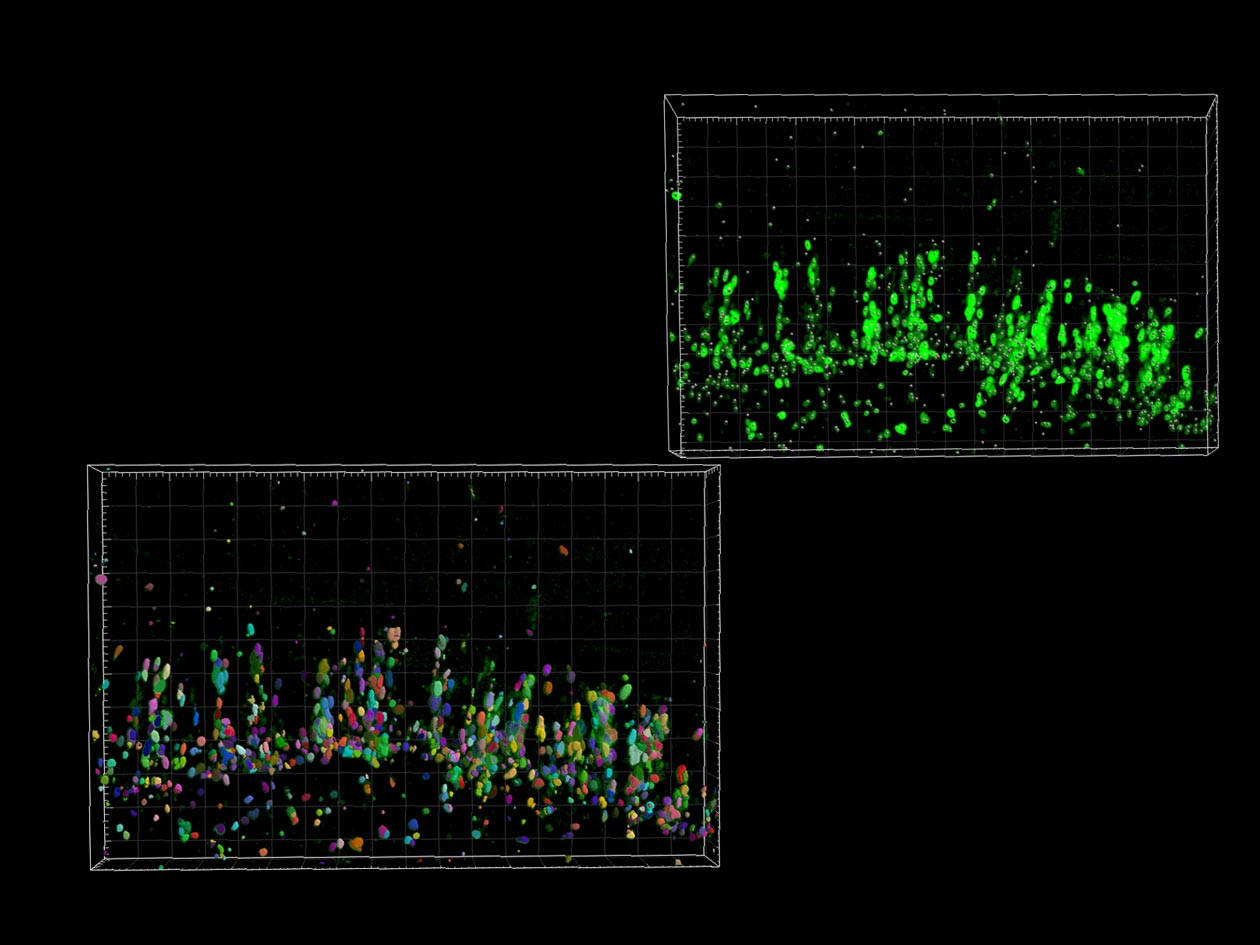
Étude du devenir des progéniteurs neuraux au sein d’organoïdes
L’équipe de Vanessa Ribes à l’Institut Jacques Monod (UMR7592) développe des protocoles afin de différencier des souches embryonnaires murines en organoïdes, composés de neurones sensoriels similaires à ceux de la moelle épinière embryonnaire dorsale. Pour ce faire, elle étudie le devenir des progéniteurs neuraux au sein d’organoïdes soumis aux protéines BMPs (bone morphogenetic proteins).
Des analyses préliminaires sur des coupes histologiques suggéraient que la position des cellules au sein de l’organoïde déterminait les niveaux d’activité de la voie de signalisation par les BMPs dans les cellules et ainsi, leur devenir. L’équipe a fait appel à ImagoSeine pour établir un protocole d’imagerie confocale des organoïdes immunomarqués, compensant la perte de signal due à l’épaisseur des tissus imagés et optimisant la résolution des échantillons. Les ingénieurs de la plateforme ont ensuite défini un pipeline sur le logiciel Imaris afin de segmenter l’ensemble des noyaux des organoïdes et de quantifier les niveaux d’expression des protéines Smads1/5/8 phosphorylées, qui agissent en aval des BMPs.
Cette collaboration a démontré que l’activité des protéines Smads présente un gradient au travers des tissus des organoïdes soumis aux BMPs. Les cellules à l’extérieur ont des niveaux d’expression des gènes supérieurs par rapport à celles à l’intérieur. Ce gradient génère des neurones avec une identité variable en fonction de leur position au sein de l’organoïde.
Pour en savoir plus : Duval N. et al. (2019). BMP4 patterns Smad activity and generates stereotyped cell fate organization in spinal organoids. Development, 146(14):dev175430.
Contact
ImagoSeine
Institut Jacques Monod
15 rue Hélène Brion
75013 Paris
Région : Île-de-France +33 (0)1 57 27 81 56
+33 (0)1 57 27 81 56
imagoseine@ijm.fr
Site de la plateforme
THÉMATIQUES : Cytométrie, Imagerie cellulaire
RESPONSABLES SCIENTIFIQUES :
René-Marc Mège, Jean-Marc Verbavatz
RESPONSABLES TECHNIQUES :
Xavier Baudin, Nicolas Valentin, Rémi Le Borgne
TUTELLES : CNRS, Université Paris Cité
INFRASTRUCTURES NATIONALES : France-BioImaging
LABELLISATION IBiSA : 2009
MOTS CLÉS : Imagerie, Microscopie photonique, Cytométrie en flux, Microscopie électronique, Plein-champ, Confocal, Biphoton, Super-résolution, Etudes ultrastructurales, Immunolocalisation, Corrélative, Imageur en flux, Tomographie, Cryofixation, SBF, Analyse cellulaire, Tri cellulaire, Analyse d’images
Fiche mise à jour en 2024










