MicroPICell
Des outils, des méthodes et des ressources en préparation d'échantillons, microscopie photonique, traitement et analyse d'images pour la biologie cellulaire et tissulaire.
MicroPICell
Des outils, des méthodes et des ressources en préparation d'échantillons, microscopie photonique, traitement et analyse d'images pour la biologie cellulaire et tissulaire.
MicroPICell
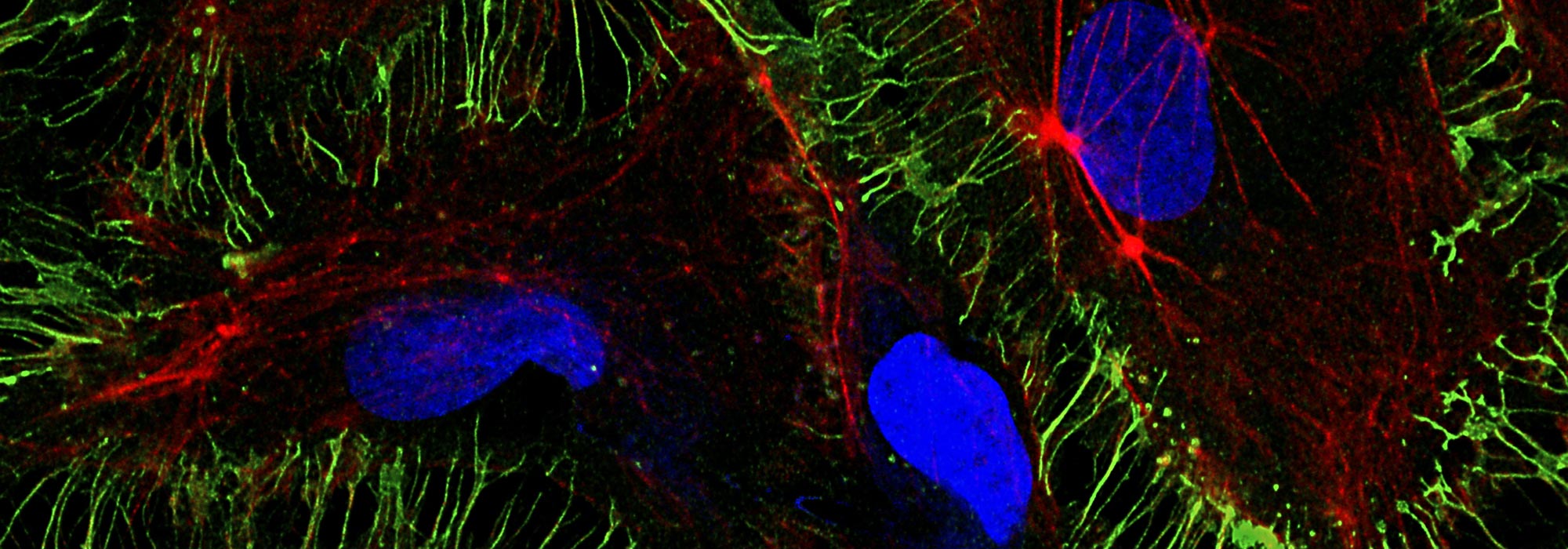
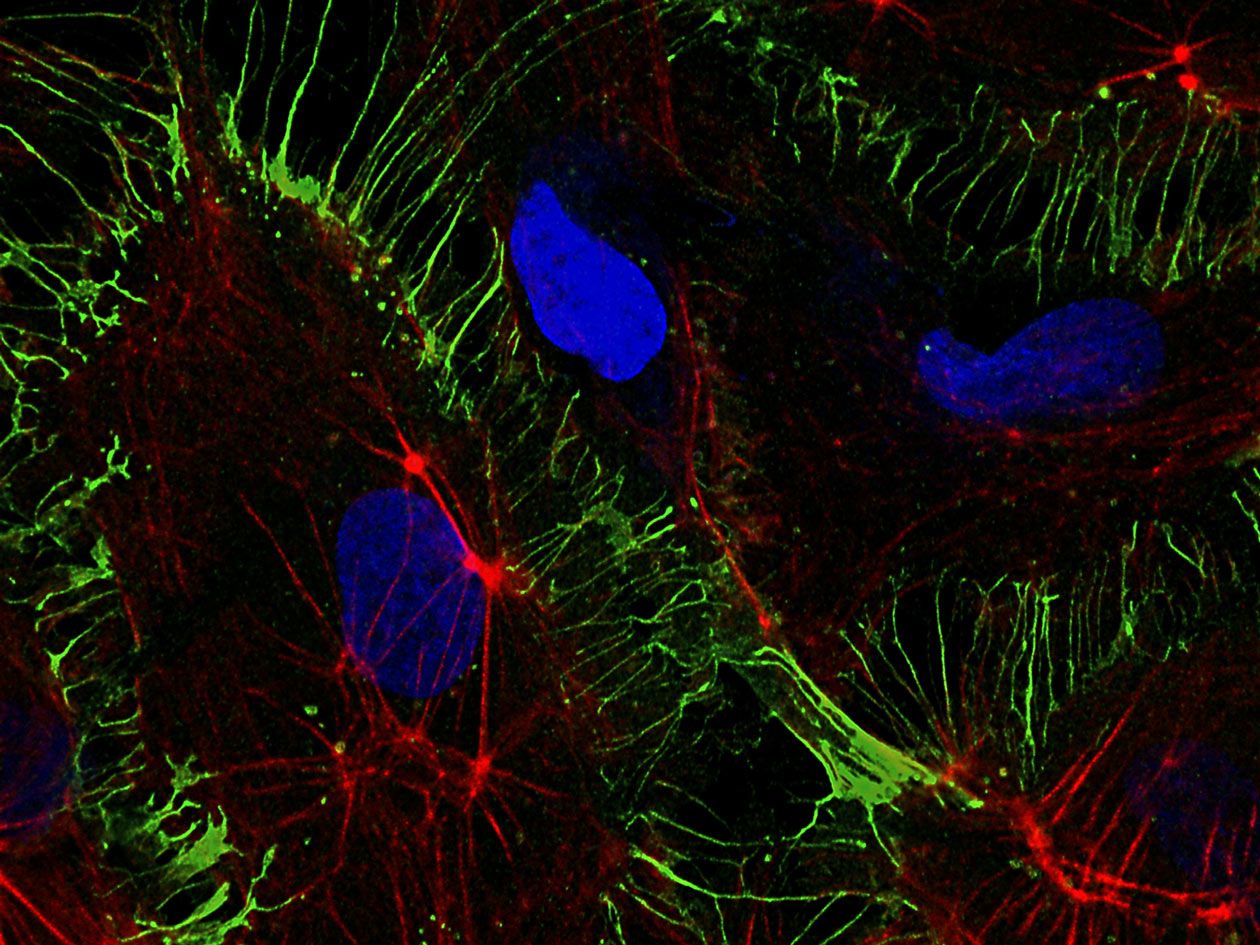
MicroPICell propose à l’ensemble de la communauté scientifique, académique et industrielle, une offre de services intégrée en imagerie cellulaire et tissulaire. Le personnel de la plateforme assure la préparation des échantillons : inclusion, congélation, coupe de tissus biologiques, coloration et immunomarquage. Les lames peuvent être numérisées grâce à un scanner, stockées et partagées à distance sur un serveur dédié.
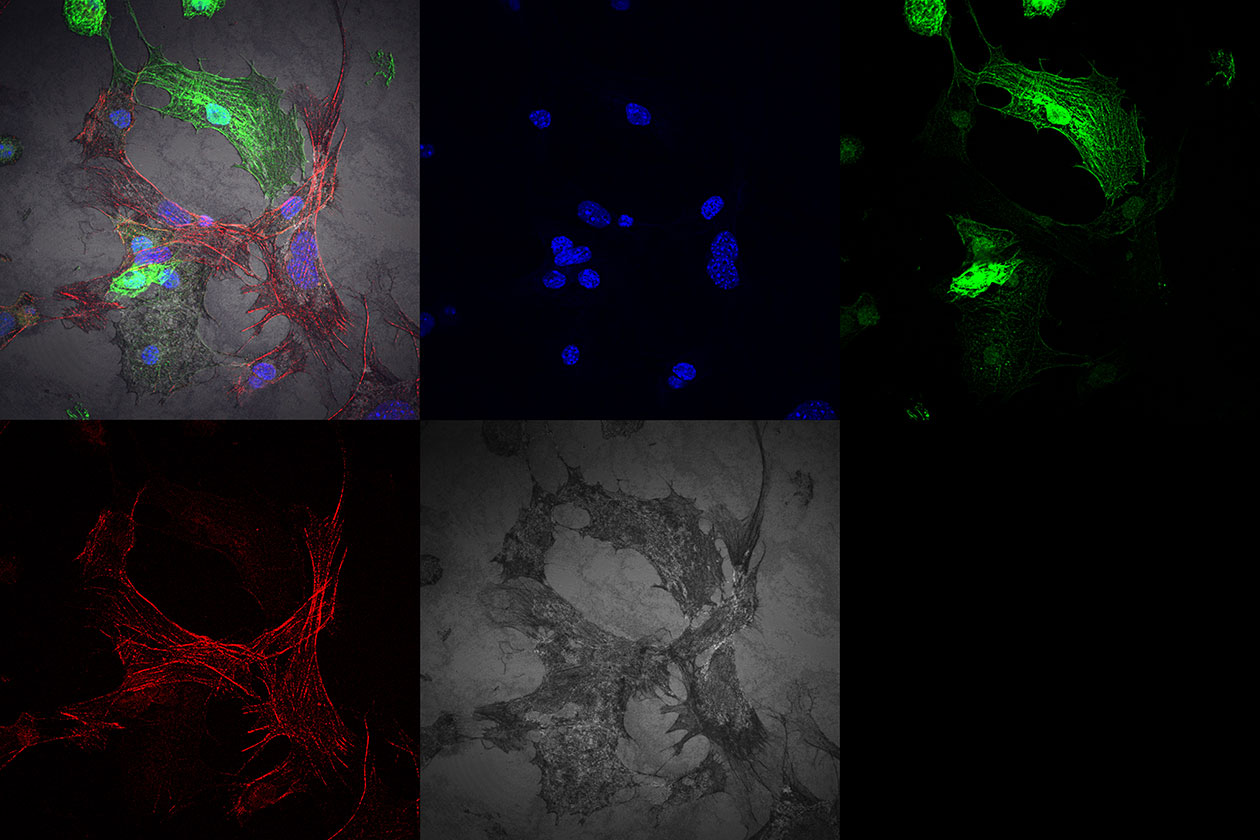
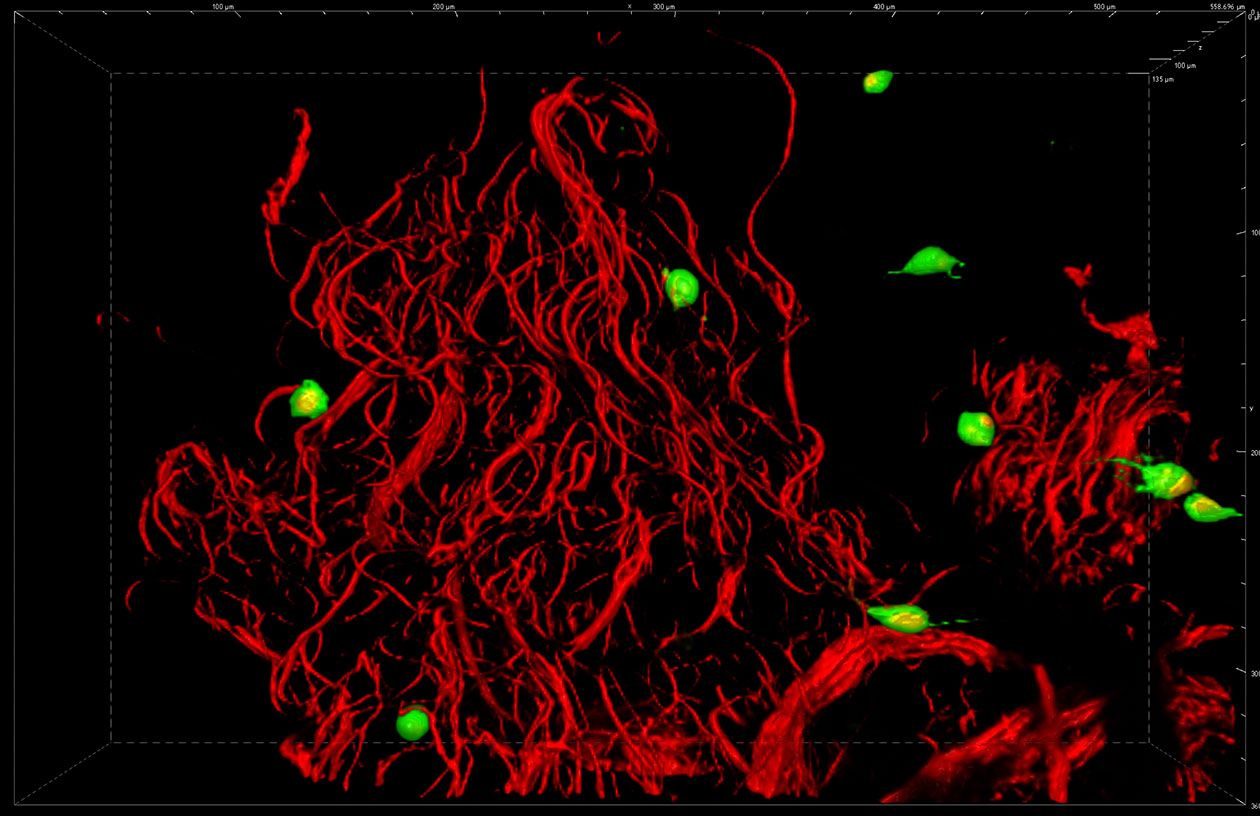
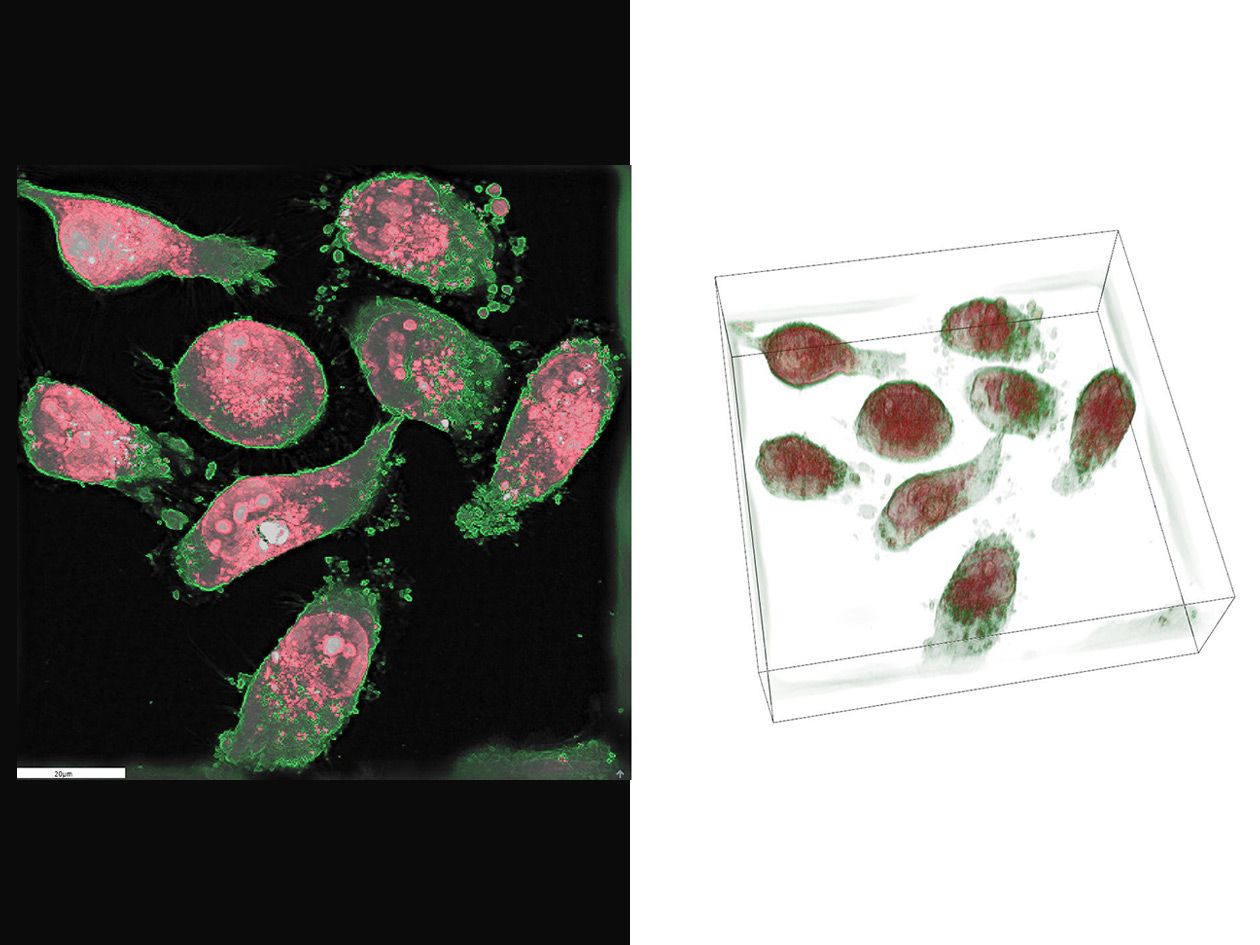
Les préparations fluorescentes, fixées ou vivantes, peuvent être visualisées sur différents systèmes de microscopie : confocal, super-résolution, champ large… Des prestations plus spécifiques telles que la microfluidique, la déconvolution spectrale confocale, l’imagerie confocale à très haute résolution temporelle, les mesures de temps de vie de fluorescence et le micropatterning, sont également disponibles.
Le service de traitement d'images de la plateforme propose la gestion du stockage et du partage des images, le conseil et l’accompagnement dans l’analyse des données, la conception d’analyses spécifiques, l’écriture de macros pour automatiser les mesures et la réalisation de programmes d’analyse complexes.
Expertises et services
- Microscopie confocale multi-couleurs et spectrale, à haut débit et à haute résolution temporelle,
- Vidéomicroscopie et mesure dynamique (tracking cellulaire, mesure de flux ioniques…),
- Microscopie de super-résolution SIM et TIRF,
- Histologie : multimarquage, immunohistochimie, immunofluorescence, coloration de tissus biologiques, tissue microarray,
- Analyse d’images pour des traitements manuels ou de pré-automatisation (ImageJ, Icy, Volocity, Imaris, ilastik, QuPath…),
- Réalisation ou modification de scripts (ImageJ, Icy, Matlab, Java, Python),
- Réalisation de mesures statistiques et mise en forme des résultats (Prism, Matlab, R...),
- Mise à disposition d’une plateforme web de gestion et partage des images (openImaDis),
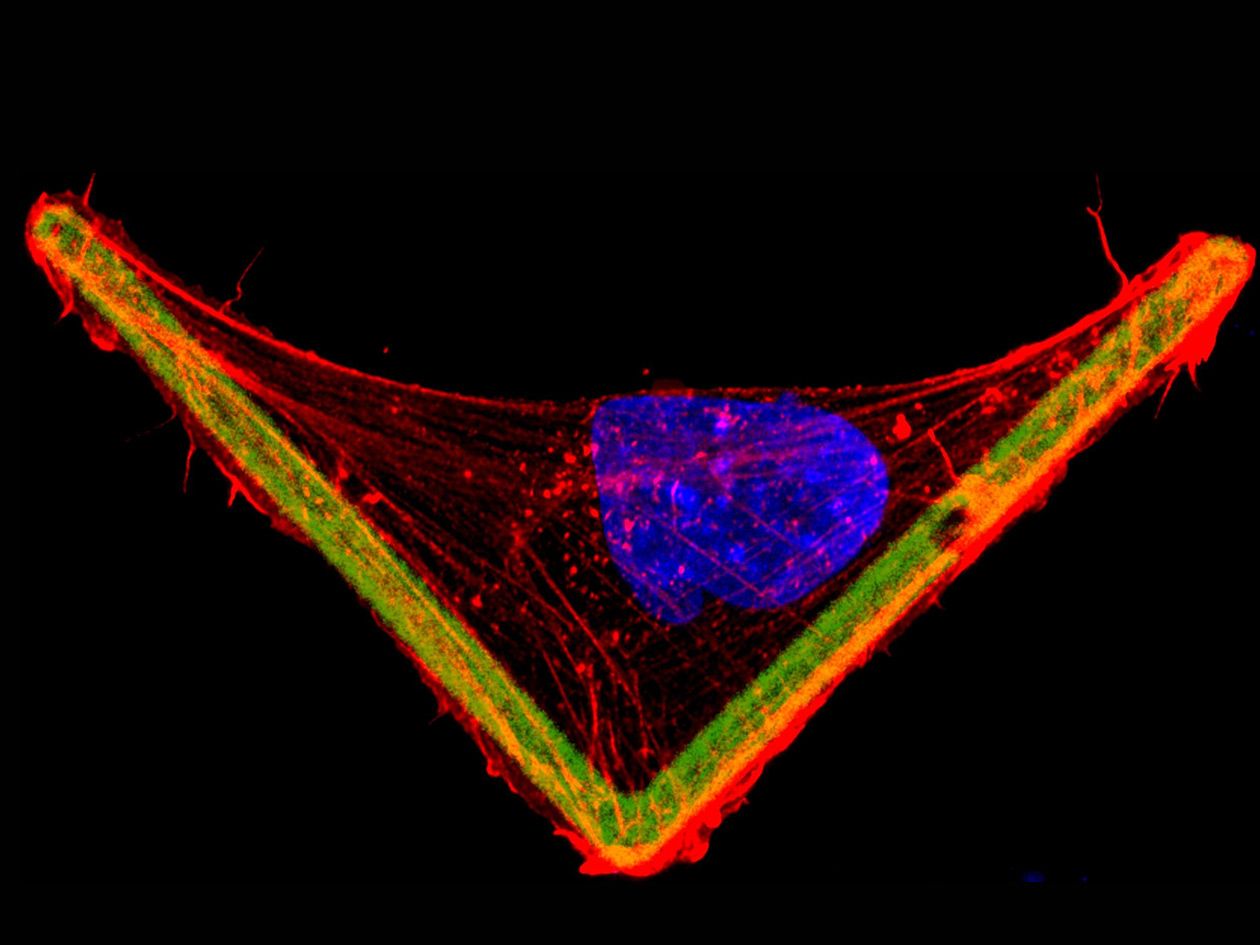
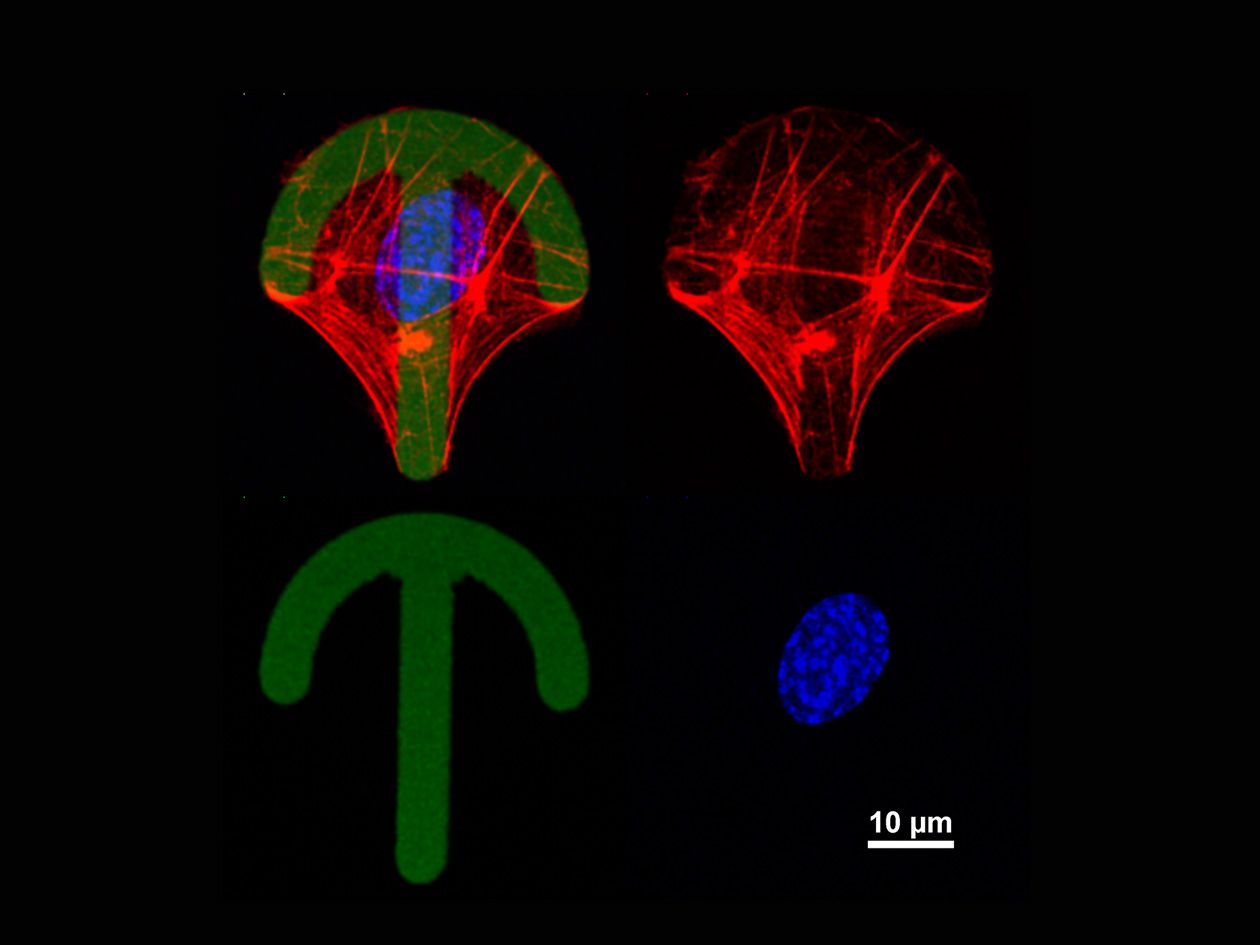
- Réalisation de micropatterns (fonctionnalisation résolue dans l’espace de surfaces de culture cellulaire),
- Conception et rédaction d’algorithmes de traitement d’images (java, python…).
- Conception de processus d’automatisation du pilotage des microscopes à fluorescence,
- Production de pièces en impression 3D,
- Inclusion en paraffine de tissus biologiques,
- Production de lames paraffinées et congelées (coupes de tissus et dépôts sur lames),
- Mise au point et réalisation de colorations et d'immunomarquages,
- Formation à l’utilisation des systèmes d’imagerie, à la préparation et coupe d'échantillons, ainsi qu’aux méthodes d'analyse d'images (colocalisation, tracking, segmentation...).
Moyens et équipements
- Microscope multimodal Nikon confocal A1 et super-résolution SIM,
- Microscope confocal Nikon A1 Resonant Spectral,
- Microscope confocal Nikon AX LIPSI,
- Scanner de lames Hamamatsu NanoZoomer 2.0-HT (couleur et fluorescence),
- Scanner de lames Hamamatsu S360 (couleur),
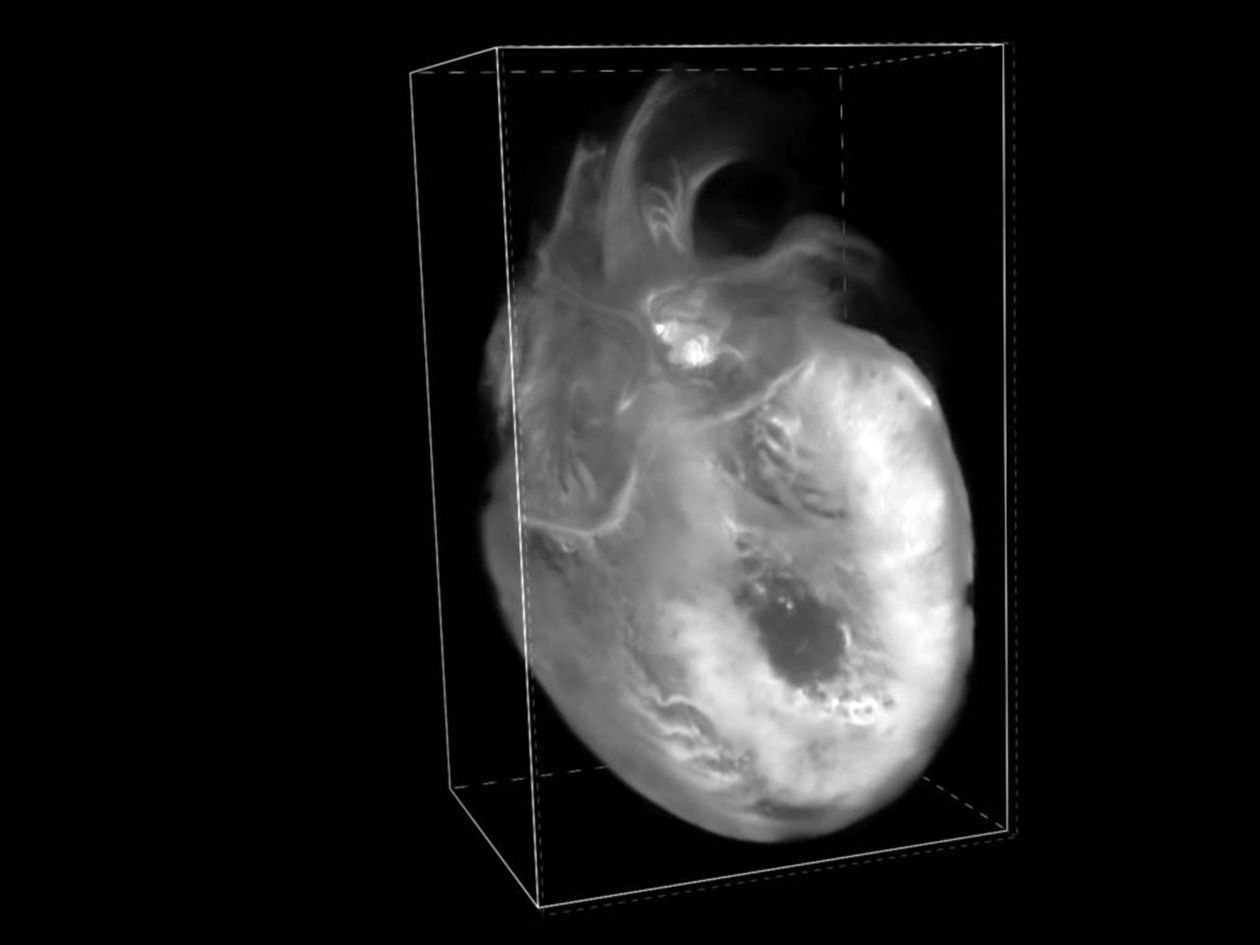
- Microscope à feuille de lumière Zeiss LS7,
- Système de fonctionnalisation de surfaces (micropatterning) Primo Alvéole,
- Microscope vidéo Nikon TiE et source Spectra Lumencor,
- Stéréomacroscope à fluorescence Zeiss Axio Zoom et Apotome (sectionnement optique),
- Vidéomicroscope Leica DMI8 time lapse,
- Microdissecteur laser MMI CellCut,
- Système de serial block-face imaging Kratoscope,
- Système Akoya Multiplex PhenoCycler,
- Automate d’immunomarquage,
- Station d'enrobage Leica,
- Cryostat et microtomes Leica,
- Automate de déshydratation Logos One,
- Automate de coloration Leica ST5020,
- Colleuse de lamelles Leica CV5030,
- TMA Builder Imstar pour la réalisation de tissue microarray,
- Système de microfluidique Bioflux 2000,
- Système de mesure de temps de vie de fluorescence Picoquant (laser pulsé 488 nm, capteur SPAD, logiciel Symphotime),
- Imprimante 3D Volumics,
- Logiciels NIS-Elements, Imaris 9, Arivis Vision 4D, Arivis VR, Volocity, Amira 3D, Metamorph Offline et Matlab.
Comment soumettre un projet ?
MicroPICell accepte tout projet réalisable par le biais des techniques et méthodes disponibles sur la plateforme. Seul le critère de faisabilité est pris en compte dans l'acceptation des projets. La première prise de contact se fait sur rendez vous, par téléphone ou par mail. Les coordonnées des personnels de la plateforme et leur service de rattachement (histologie, imagerie, analyse) sont disponibles sur le site internet de MicroPICell.
Contact
MicroPICell
8 quai Moncousu
44007 Nantes
Région : Pays de la Loire +33 (0)2 28 08 03 40
+33 (0)2 28 08 03 40
micropicell@univ-nantes.fr
Site de la plateforme
THÉMATIQUES : Bioinformatique, bases de données, Histologie, anatomopathologie, Imagerie cellulaire
RESPONSABLES SCIENTIFIQUES :
Perrine Paul-Gilloteaux, Vincent Guen
RESPONSABLES TECHNIQUES :
Steven Nedellec
RESPONSABLES QUALITÉ :
Stéphanie Blandin, Philippe Hulin
TUTELLES : CHU de Nantes, CNRS, Inserm, Nantes Université
INFRASTRUCTURES NATIONALES : France-BioImaging
LABELLISATION IBiSA : 2018
MOTS CLÉS : Bioimagerie, Microscopie photonique, Fluorescence, Histologie, Immunomarquages, Analyse d’images, Imagerie tissulaire, Imagerie cellulaire, Biogenouest
Fiche mise à jour en 2024












