Plateforme de microscopie de Rennes (MRic)
Des instruments et des expertises de haut niveau en microscopie photonique et électronique pour l'imagerie cellulaire et moléculaire au service de la recherche en biologie-santé.
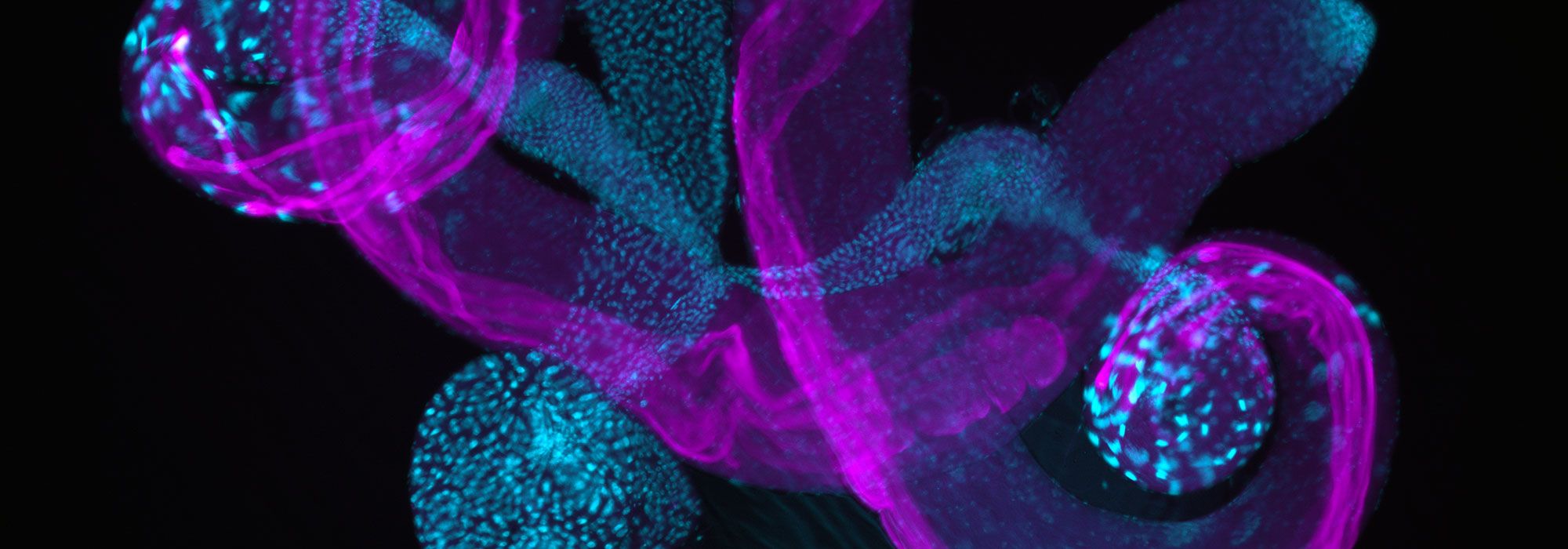
Plateforme de microscopie de Rennes (MRic)
Des instruments et des expertises de haut niveau en microscopie photonique et électronique pour l'imagerie cellulaire et moléculaire au service de la recherche en biologie-santé.
Plateforme de microscopie de Rennes (MRic)
La plateforme MRic s'articule autour de deux plateaux techniques : MRic-Photonics pour la microscopie photonique et MRic-TEM pour la microscopie électronique. Elle propose un accès réglementé à des systèmes d'imagerie, une aide scientifique et technique à la conception de projets et d'expériences, une activité de recherche et développement dédiée à la conception de prototypes de microscopes et des formations aux techniques de microscopie.
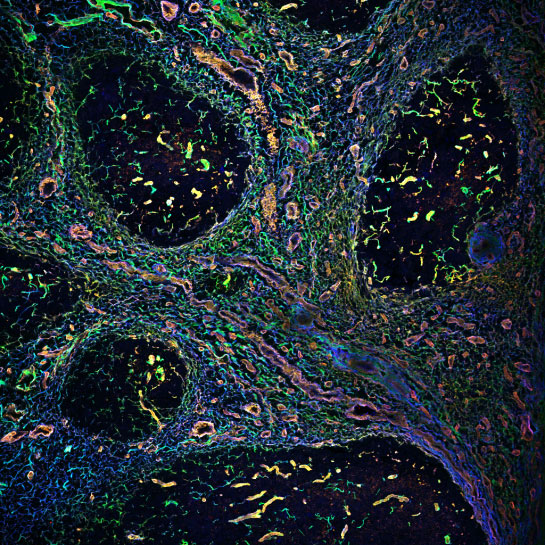
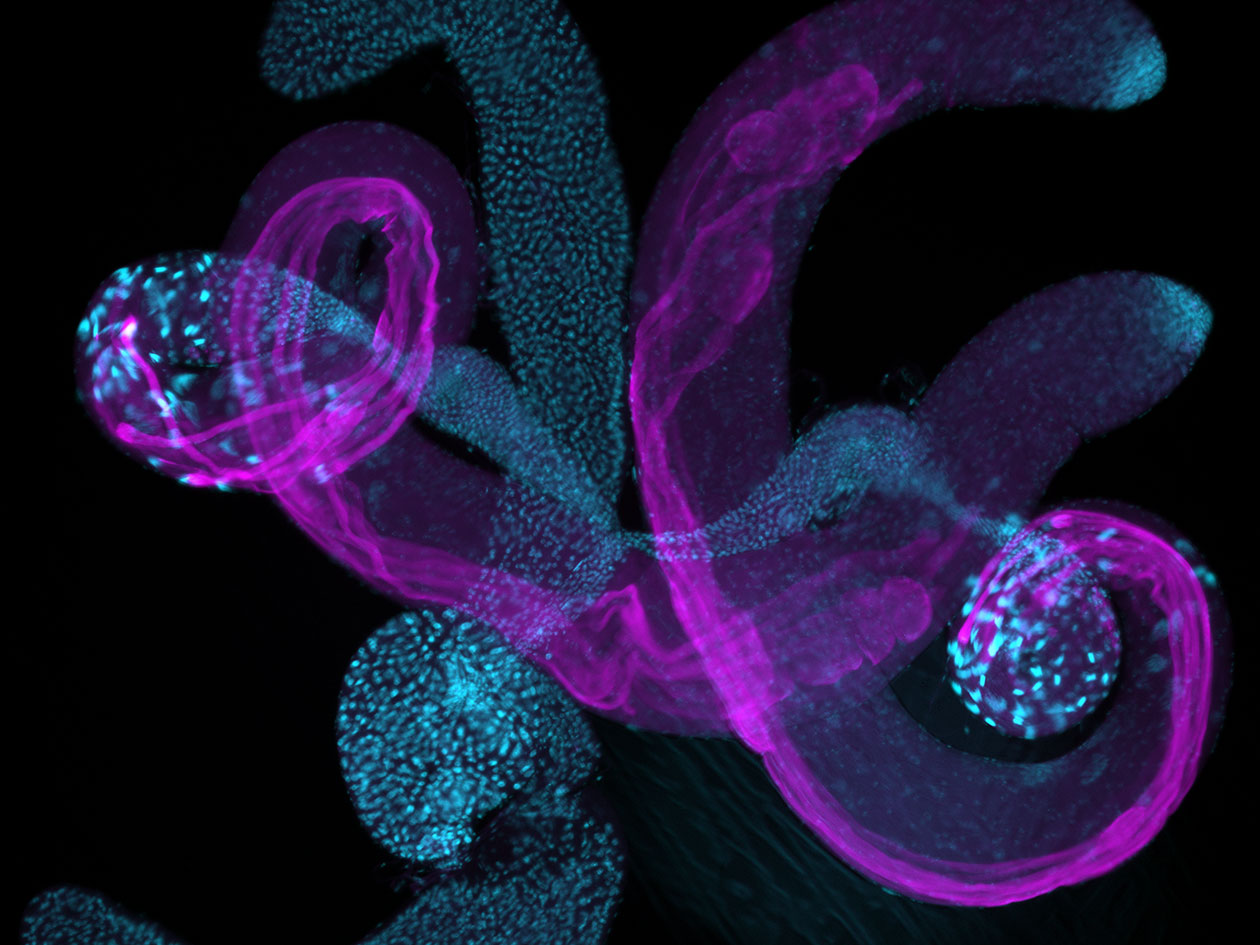
Les techniques proposées sur la plateforme sont les suivantes : vidéomicroscopie, confocal, spinning disk, feuille de lumière, F-techniques (FRAP, FRET, FLIM, FCS, FCCS, FLCS), super-résolution (STORM, Airyscan, RIM), multiphoton, photomanipulation, microscopie électronique à transmission cellulaire, immunogold, cryo-fixation à haute pression, cryo-tomographie et microscopie corrélative.
Expertises et services
- Conseil et accompagnement pour les projets en microscopie : préparation d’échantillons, acquisition d’images, analyse et interprétation des résultats,
- Mise à disposition d’équipements après formation,
- Visualisation et quantification de la fluorescence de cellules vivantes ou fixées,
- Observation de structures à l’échelle subcellulaire,
- Mesure de flux calciques,
- Evaluation d’interactions protéines-protéines,
- Visualisation de biosenseurs,
- Imagerie d’échantillons épais ou de tissus,
- Analyse d’images,
- Microscopie électronique à transmission,
- Congélation haute pression,
- Immunomarquage par billes d’or,
- Reconstruction tridimensionnelle de complexes moléculaires,
- Microscopie corrélative.
Moyens et équipements
Microscopie photonique :
- Microscope à champ large,
- 2 microscopes spinning disk, dont 2 microscopes équipés d'une tête de photomanipulation et 1 microscope équipé d’une camera emCCD,
- 5 microscopes confocaux dont 1 microscope droit, 1 microscope équipé d’un laser IR femto, 1 microscope équipé d’une tête de photomanipulation avec un laser UV pulsé, 2 microscopes équipés pour la FCS, 1 microscope équipé d’un détecteur TCSPC pour le FLIM et la FLCS, 2 microscopes équipés d’un module de super-résolution Airyscan et 1 microscope équipé d’un détecteur NSPARC de super-résolution,
- Microscope fastFLIM équipé d'un laser super-continuum pulsé,
- Microscope à feuille de lumière,
- Microscope de super-résolution par localisation de molécules individuelle (STORM/PALM),
- Microscope RIM de super-résolution en mode champ large et en profondeur,
- Platine motorisée multiposition sur quasiment tous les microscopes, dont certains sont également équipés de prismes ou d’anneaux de phase pour le Normarski ou le DIC,
- Stations de traitement et d’analyse d’images.
Microscopie électronique :
- Microscopes électroniques à transmission JEM 1400 Jeol,
- Ultramicrotomes UC7 et UCT Leica,
- Cryo-ultramicrotomes UC7 Leica,
- Système de congélation haute pression EM PACT2 Leica et CryoCapCell,
- Automate d'immunomarquage EGL Leica




Comment soumettre un projet ?
La plateforme MRic est accessible aux équipes de recherche académiques et privées. Si vous êtes nouvel utilisateur, vous pouvez envoyer un mail à l'adresse marc.tramier@univ-rennes1.fr en expliquant votre besoin. Après formation, vous pourrez accéder aux microscopes en toute autonomie et réserver les équipements en ligne sur le site de la plateforme. La facturation sera établie selon le nombre d’heures réservées. Pour une prestation de service, les modalités seront définies au premier rendez-vous.
Exemple de projet
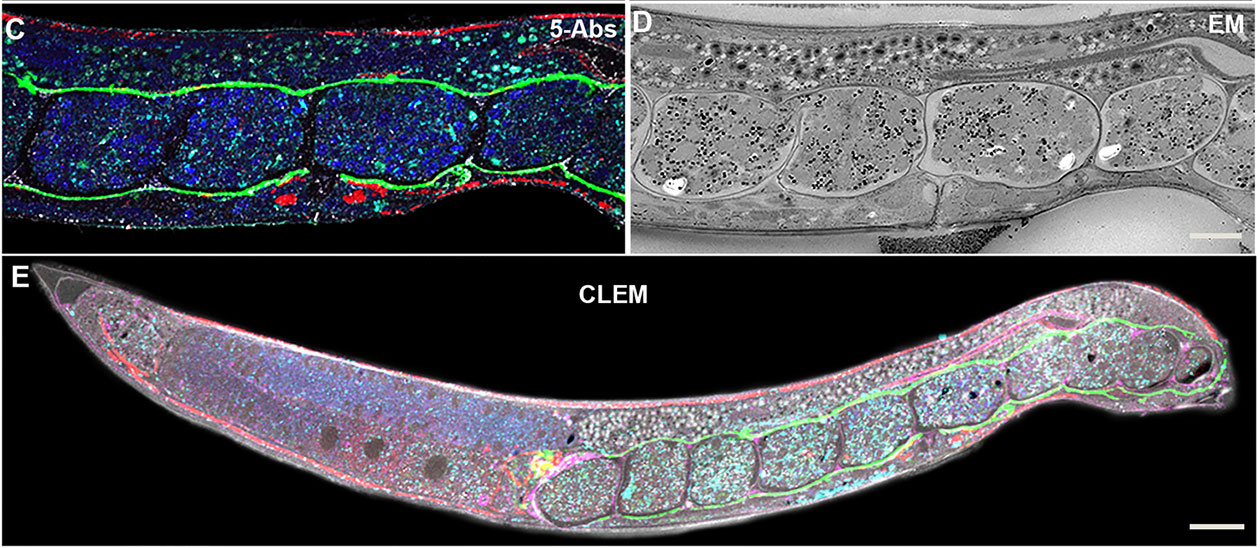
Adaptation de la technique Tokoyasu pour l'étude du ver C. elegans
L'adhésion cellule-cellule est essentielle pour l'intégrité du tissu épithélial. Pourtant, la localisation subcellulaire précise des protéines de jonction n'a jamais été déterminée dans les cellules épithéliales du modèle C. elegans. La microscopie confocale a montré qu'il existe deux complexes différents, le premier comprenant la E-cadhérine (E-cad) et le second l'orthologue du disque de grande taille (Dlg). Cependant, en microscopie électronique (EM), il n’est possible d’observer qu’une structure homogène dense aux électrons. Afin de localiser ces protéines au niveau ultrastructural dans la structure dense en électrons, la plateforme MRic a développé de nouvelles méthodes d'immuno-EM (IEM).
Les experts de la plateforme ont testé diverses conditions de fixation et établi un protocole permettant une conservation fiable et cohérente de tous les tissus. Ils ont ensuite testé en parallèle les protocoles IEM, montrant que la meilleure méthode reposait sur la technique Tokoyasu encore jamais adaptée à C. elegans, alors que les protocoles classiques d’IEM n’ont pas été satisfaisants. Avec l’utilisation d’un anticorps anti-actine, la méthode a permis une augmentation robuste de cinq fois la coloration. Aujourd’hui, elle est régulièrement exploitée pour analyser la collection d’anticorps de la plateforme.
Pour en savoir plus : Nicolle O. et al. (2015). Adaptation of cryo-sectioning for IEM labeling of asymmetric samples: a study using Caenorhabditis elegans. Traffic, 16(8):893-905.
Contact
MRic
UAR Biosit
Campus santé de Villejean
2 avenue du Pr Léon Bernard
35043 Rennes
Région : Bretagne +33 (0)2 23 23 49 94
+33 (0)2 23 23 49 94
marc.tramier@univ-rennes1.fr
Site de la plateforme
THÉMATIQUES : Imagerie cellulaire
RESPONSABLES SCIENTIFIQUES :
Marc Tramier (MRic), Sébastien Huet et Frédéric Mourcin (MRic-Photonics), Grégoire Michaux (MRic-TEM)
RESPONSABLES TECHNIQUES :
Stéphanie Dutertre (MRic-Photonics), Agnès Burel (MRic-TEM)
RESPONSABLES QUALITÉ :
Stéphanie Dutertre
TUTELLES : CNRS, Inserm, Université de Rennes
INFRASTRUCTURES NATIONALES : France-BioImaging
LABELLISATION IBiSA : 2009
MOTS CLÉS : Epifluorescence, Micro-injection, Vidéomicroscopie, Confocal, Spinning disk, F-techniques, FRAP, FRET, FLIM, FCS, FCCS, FLCS, Photo-manipulation, Multiphoton, Feuille de lumière, Super-résolution, Microscopie électronique à transmission, Immunomarquage à billes d'or, Congélation à haute pression, Microscopie corrélative, Biogenouest
Fiche mise à jour en 2025












